9.已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是( )
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
8.2010年诺贝尔化学奖化学授予理查德•赫克等三位科学家,以表彰他们在“钯催化交叉偶联”方面的研究.下面关于催化剂的说法正确的是( )
| A. | 催化剂能够改变反应的反应热 | |
| B. | 催化剂能够改变反应物的活化分子百分数 | |
| C. | 催化剂能改变反应物的转化率 | |
| D. | 催化剂通过升高反应的活化能来加快反应速率 |
6.同温同压下,下列各反应均为放热反应,则各热化学方程式中Q数值最小的是( )
| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
5. 目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )
 目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )| A. | 通入乙醇的电极为该电池的正极 | |
| B. | 电池工作过程中,H+从正极区向负极区迁移 | |
| C. | 该电池的正极反应为:4H++O2+4e-=2H2O | |
| D. | 每消耗0.1molC2H5OH,就会有0.6mole-经过导线 |
4.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,下列说法正确的是( )


| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜左侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mole-时,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应会改变 |
3.如图小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片.实验观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
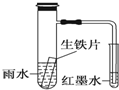

| A. | 生铁片中的碳是原电池的负极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片始终发生析氢腐蚀 | |
| C. | 具支试管中溶液酸性增强 | |
| D. | 墨水回升时,碳电极反应式为O2+2H2O+4e-═4OH- |
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
20.某高分子化合物R的结构简式为 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )
0 168130 168138 168144 168148 168154 168156 168160 168166 168168 168174 168180 168184 168186 168190 168196 168198 168204 168208 168210 168214 168216 168220 168222 168224 168225 168226 168228 168229 168230 168232 168234 168238 168240 168244 168246 168250 168256 168258 168264 168268 168270 168274 168280 168286 168288 168294 168298 168300 168306 168310 168316 168324 203614
 ,下列有关R的说法正确的是( )
,下列有关R的说法正确的是( )| A. | R的一种单体的分子式可能为C9H10O2 | |
| B. | R完全水解后生成物均为小分子有机物 | |
| C. | 可以通过加聚反应和缩聚反应合成R | |
| D. | 碱性条件下,1 mol R完全水解消耗NaOH的物质的量为2 mol |
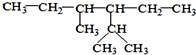 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷.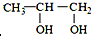 <
< 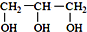 (填“>”“<”或“=”,下同)
(填“>”“<”或“=”,下同) <
<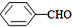
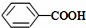 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)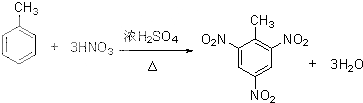 ;
;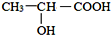 )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
.