题目内容
2.下列说法正确的是( )| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
分析 A.气体体积减小是熵减的反应△S<0;
B.锌与硫酸铜反应置换出铜与锌可形成原电池反应;
C.浓硫酸与铁发生钝化;
D.燃烧热是1mol该物质完全燃烧生成稳定化合物所放出的热量.
解答 解:A.反应是气体体积减小的反应,熵变也减小,故A正确;
B.锌置换出铜,可形成原电池反应,反应速率增大,故B错误;
C.浓硫酸与铁发生钝化,不生成氢气,所以用浓硫酸与铁反应不能增大生成H2的速率,故C错误;
D.燃烧热是1mol该物质完全燃烧生成稳定化合物所放出的热量,题干中水的状态为气态,所以不是燃烧热,故D错误;
故选A.
点评 本题考查较为综合,涉及化学反应速率的影响,反应热及熵变,为高频考点,侧重于基本理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
19.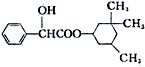 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物质的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物不能被氧化成醛 | |
| C. | 分子式为C17H23O3 | |
| D. | 1mol该物质最多可与2 mol NaOH发生反应 |
17.有一种脂肪醇,通过一系列反应可变为丙三醇,这种醇也可通过消去、氧化、酯化、加聚反应等变化后可转化为一种高聚物 ,这种醇的结构简式为( )
,这种醇的结构简式为( )
 ,这种醇的结构简式为( )
,这种醇的结构简式为( )| A. | CH2═CHCH2OH | B. | CH3CH2OH | C. | CH3CH(OH)CH2OH | D. | CH2ClCHClCH2OH |
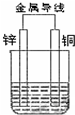
14.将洁净的金属片Fe、Zn、A、B 分别与Cu用导线连结浸在合适的电解质溶液里.实验并记录电压指针的移动方向和电压表的读数如下表所示.根据以上实验记录,完成以下填空:
①构成两电极的金属活动性相差越大,电压表的读数越大(填“大”、“小”).上述五种金属的金属性由强到弱的顺序是Zn>Fe>B>Cu>A.
②Cu与A组成的原电池,Cu为负极,此电极反应式为Cu-2e-=Cu2+.
③A、B形成合金,露置在潮湿空气中,B先被腐蚀.
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | A←Cu | -0.15 |
| B | B→Cu | +0.3 |
②Cu与A组成的原电池,Cu为负极,此电极反应式为Cu-2e-=Cu2+.
③A、B形成合金,露置在潮湿空气中,B先被腐蚀.
12.分子式为C8H10的苯的同系物的种数是( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |

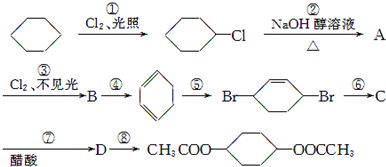
 ,C:
,C: .
. +2NaCl+2H2O
+2NaCl+2H2O
 .
.