题目内容
6.同温同压下,下列各反应均为放热反应,则各热化学方程式中Q数值最小的是( )| A. | 2A(l)+B(l)=2C(g)△H1=-Q1 | B. | 2A(g)+B(g)=2C(g)△H2=-Q2 | ||
| C. | 2A(g)+B(g)=2C(l)△H3=-Q3 | D. | 2A(l)+B(l)=2C(l)△H4=-Q4 |
分析 反应物的总能量高于生成物的总能量,为放热反应,反应热符号为“-”,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,反应热越小,结合物质的状态进行判断,同一物质的能量g>l>s.
解答 解:各反应中对应物质的物质的量相同,同一物质的能量g>l>s,所以反应物的总能量为:B=C>A=D,生成物的能量为:A=B>C=D,反应为放热反应,反应物的总能量越高,生成物的总能量越低,反应放出的热量越多,故A放出的热量最少,反应热符号为“-”,反应放出的热量越小,Q数值最小,故A的Q数值最小,
故选A.
点评 本题考查物质能量、物质状态与反应热的关系,难度不大,注意根据能量守恒理解物质能量与反应热关系,注意反应热比较包含符号进行比较.

练习册系列答案
相关题目
3.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
4.已知热化学方程式:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
11.在一密闭容器中,反应aA(g)+bB(g)?cC(g),达到平衡时,测得c(A)为0.5mol•L-1;在温度不变的条件下,将容器体积扩大一倍,当重新达到平衡时,测得c(A)为0.3mol•L-1.则下列判断不正确的是( )
| A. | 化学计量数:a+b>c | B. | 平衡向逆反应方向移动了 | ||
| C. | 物质B的转化率增加了 | D. | 物质B的物质的量增加了 |
18.下列各分子式只表示一种物质的是( )
| A. | CH2Br2 | B. | C3H7Cl | C. | C4H10 | D. | C |
15.某元素由2种同位素组成,其原子比为5:2,第一种同位素的二价阳离子有27个电子,34个中子;第二种同位素原子的中子数比第一种多2个,该元素的平均近似相对原子质量为( )
| A. | 63.47 | B. | 64.47 | C. | 63.57 | D. | 64.57 |
16.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能与水发生加成反应 | |
| B. | 实验室制溴苯时选用的试剂可以是溴水、苯和铁屑 | |
| C. | 配制银氨溶液时,将氨水逐滴加到 AgNO3溶液中,边加边振荡,直至沉淀恰好完全消失 | |
| D. | 银镜反应实验后试管内壁附有银,可用稀硫酸清洗 |
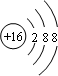 ,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为:
,F元素周期表的位置:第三周期第ⅦA族,C2B2的电子式为: .AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.
.AB2的结构式为:O=C=O.该化合物是由极性(填“极性”、“非极性”)键形成的.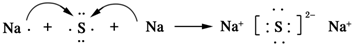 .该化合物属于离子(填“共价”或“离子”)化合物.
.该化合物属于离子(填“共价”或“离子”)化合物.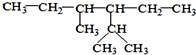 的系统命名为:2,4-二甲基-3-乙基己烷.
的系统命名为:2,4-二甲基-3-乙基己烷.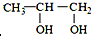 <
< 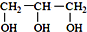 (填“>”“<”或“=”,下同)
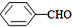
(填“>”“<”或“=”,下同) <
<
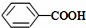 >CH3COOH(提示:类比酚与醇的酸性)
>CH3COOH(提示:类比酚与醇的酸性)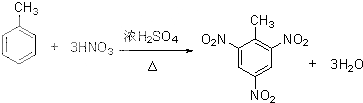 ;
;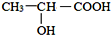 )在催化剂条件下,合成聚乳酸(PLA)的反应方程式:
)在催化剂条件下,合成聚乳酸(PLA)的反应方程式: .
.