题目内容
4.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,下列说法正确的是( )
| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜左侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mole-时,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应会改变 |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、放电时,交换膜右侧的氯离子向负极移动;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动;
D、根据电池总反应判断.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,交换膜右侧的氯离子向负极移动,所以左侧溶液中有大量白色沉淀氯化银生成,故B正确;
C、放电时,当电路中转移0.1mol e-时,交换膜左则会有0.1mol氢离子通过阳离子交换膜向正极移动,故C错误;
D、根据电池总反应为2Ag+Cl2═2AgCl可知,用KCl溶液代替盐酸,电池的总反应不变,故D错误;
故选B.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 化学反应中的能量变化均表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中的能量变化的主要原因 | |
| C. | 需要加热才能够发生的反应一定是吸热反应 | |
| D. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
2.某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
为验证丁同学的猜想合理与否?请同学们根据结论完成下表的实验设计方案.可选用试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、0.1mol•L-1FeCl3、0.1mol•L-1CuSO4、20%KSCN、蒸馏水.
固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 | ? |
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
19.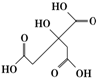 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
 物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )
物质X的结构式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是化学中间体.下列关于物质X的说法正确的是( )| A. | X分子式为C6H7O7 | |
| B. | 1 mol物质X可以和4mol氢氧化钠发生反应 | |
| C. | X分子内所有原子均在同一平面内 | |
| D. | 足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
9.已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是( )
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
16.按反应特征与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种,下列变化中不属于取代反应的是( )
| A. | C6H5CH2Cl+NaCN-→C6H5CH2CN+NaCl | B. | 2Na+2 C2H5OH-→2C2H5ONa+H2↑ | ||
| C. | CH3CH2CHO+HCN-→CH3CH2CH(CN)OH | D. | CH3COOC2H5+H2O-→CH3COOH+C2H5OH |
13.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 化学反应一定有新物质的生成,但不一定有能量的变化 |
14.下列关于苯酚的叙述中,错误的是( )
| A. | 其水溶液显弱酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 苯酚溶液不能使酸性高锰酸钾溶液褪色 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: