题目内容
7.1g氨气完全分解为氮气、氢气时,吸收2.72kJ的热量,下列热化学方程式正确的是( )①N2(g)+3H2(g)=2NH3(g)△H=-46.2kJ/mol
②N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol
③NH3(g)=$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)△H=+46.2kJ/mol
④2NH3(g)=N2(g)+3H2(g)△H=-92.4kJ/mol.
| A. | 全部 | B. | ①②③ | C. | ①② | D. | ②③ |
分析 n(NH3)=$\frac{1g}{17g/mol}$=$\frac{1}{17}$mol,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,热量多少与各物质的化学计量数或物质的量有关.
解答 解:n(NH3)=$\frac{1g}{17g/mol}$=$\frac{1}{17}$mol,则分解1molNH3吸收17×2.72kJ=46.24kJ能量,生成1molNH3放出46.24kJ能量,则生成2molNH3放出2×46.24kJ≈92.4kJ,故①错误,②正确;
③分解1molNH3吸收17×2.72kJ=46.24kJ能量,故③正确;
④分解2molNH3吸收92.4kJ能量,而不是放出,故④错误,
故选D.
点评 本题考查热化学方程式,题目难度不大,注意书写热化学方程式时,要标明物质的状态,其热量多少与各物质的化学计量数或物质的量有关,△H>0表明是吸收热量,△H<0表明是放出热量.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 2NO(g)+2CO(g)═N2(g)+2CO2(g)该反应是熵减的反应 | |
| B. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率减慢 | |
| C. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 | |
| D. | 由H2(g)+1/2O2(g)═H2O(g)△H=-241.8 kJ•mol-1,得出H2的燃烧热是241.8 kJ•mol-1 |
12.将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g)△H<0.当改变某个条件并达到新平衡后,下列叙述正确的是( )
| A. | 升高温度,Z的体积分数增大 | |
| B. | 增大压强(缩小容器体积),平衡不移动,Z的浓度不变 | |
| C. | 若平衡体系中共有amol气体,再加入amol的X(g),达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持容器体积不变,充入一定量的Z,达到新平衡时,X的体积分数增大 |
19.下列化学式及结构式中,从成键情况看不合理的是( )
| A. | CH4Si: | B. | CH4S: | C. | CH2SeO: | D. | CH3N: |
17.实验室用图所示的装置制取乙酸乙酯,下列说法正确的是( )


| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 用CH3CH218OH与乙酸反应制取乙酸乙酯,18O 存在于水中 | |
| C. | 试管b中的液体是饱和NaHCO3溶液 | |
| D. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
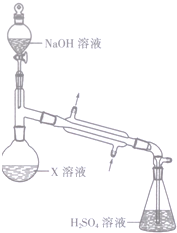 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验. →
→ .
.