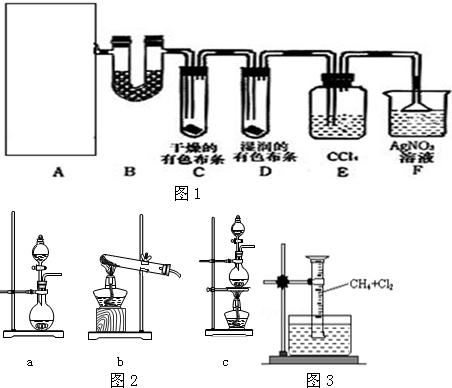
13.下列说法正确的是( )
| A. | 放热反应一定是断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量少 | |
| B. | 1molH2SO4和1molBa(OH)2完全反应所放出的热量称为中和热 | |
| C. | 反应物的总能量低于生成物的总能量的化学反应为放热反应 | |
| D. | 在化学反应中需要加热的反应就是吸热反应 |
12.下列物质属于烃类的是( )
| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
11.在反应:C+CO2 ?2CO中,可使反应速率增大的措施是( )
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤用等量炭粉代替焦炭.
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤用等量炭粉代替焦炭.
| A. | ①②③ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
10.(1)A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如表所示:
根据上述信息,写出B的基态原子核外电子排布式1s22s22p63s2,预测A和氯元素形成的简单分子空间构型为直线型.
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律随阴阳离子的半径增大,熔降低点.
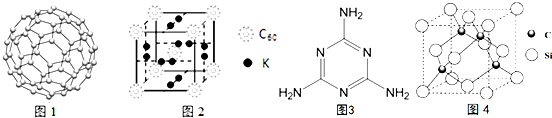
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
9.烷基取代苯 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
7.下列各组粒子中,互为同位素的是( )
0 168120 168128 168134 168138 168144 168146 168150 168156 168158 168164 168170 168174 168176 168180 168186 168188 168194 168198 168200 168204 168206 168210 168212 168214 168215 168216 168218 168219 168220 168222 168224 168228 168230 168234 168236 168240 168246 168248 168254 168258 168260 168264 168270 168276 168278 168284 168288 168290 168296 168300 168306 168314 203614
| A. | O2和O3 | B. | SO2和SO3 | C. | 12C和13C | D. | D2O和T2O |
 芳香烃,(7)
芳香烃,(7) 酚,(8)
酚,(8)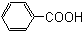 芳香酸.
芳香酸.