题目内容
11.在反应:C+CO2 ?2CO中,可使反应速率增大的措施是( )①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤用等量炭粉代替焦炭.
| A. | ①②③ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
分析 增大反应的化学反应速率,可通过增大浓度、升高温度、使用催化剂、增大反应物接触面积等措施,对于气体参加的反应,还可以增大压强,以此解答该题.
解答 解:①缩小容器体积,压强增大,反应速率加快,故①正确;
②升温,正逆反应速率增大,故②正确;
③通入CO2,CO2浓度增大,反应速率加快,故③正确;
④C是固体,增加C的量,不影响反应速率,故④错误;
⑤用等量炭粉代替焦炭,增大了反应物的接触面积,反应速率加快,故⑤正确,
故选C.
点评 本题考查化学反应速率的影响因素,侧重于学生的基本概念的理解和运用,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.卤族元素随着原子序数的增大,下列递变规律正确的是( )
| A. | 原子半径逐渐增大 | |
| B. | 单质熔、沸点逐渐降低 | |
| C. | 单质的氧化性逐渐增强 | |
| D. | 最高价氧化物的水化物的酸性逐渐增强 |
19.下列属于极性分子的是( )
| A. | NH3 | B. | H2 | C. | CH4 | D. | BF3 |
6.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
①质子数相同的粒子一定属于同种元素
②同位素的物理性质有较大差别而化学性质几乎完全相同
③元素种类由质子数决定,原子种类由质子数和中子数共同决定,元素主要化学性质由最外层电子数决定
④电子数相同的粒子不一定是同一种元素
⑤每种元素都有两种或两种以上的核素.
| A. | ①②④⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ①⑤ |
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g | |
| D. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
20.下列电子式中,书写正确的是( )
| A. | 过氧化钠 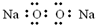 | B. | 氟化氢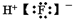 | C. | 氮气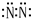 | D. | 氯化镁 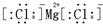 |
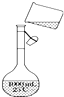 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)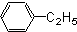 芳香烃,(7)
芳香烃,(7)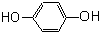 酚,(8)
酚,(8)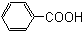 芳香酸.
芳香酸. 用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下:
用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取 电解二氧化锰(EMD)的工艺流程如下: Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s)
Fe(OH)3+3H+,加入CaCO3后,由于CaCO3(s) Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.
Ca2+(aq)+CO32-(aq),CO32-+2H+═CO2↑+H2O,使得Fe3+的水解平衡向正反应方向移动,Fe3+转化为Fe(OH)3沉淀而被除去.