题目内容
14.氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O $\frac{\underline{\;\;\;\;\;激光\;\;\;\;\;}}{TiO2}$ 2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题:(1)分解海水时,二氧化钛作催化剂.生成的氢气用于燃料电池时,化学能转变为电能.分解海水的反应属于吸热反应(填“放热”或“吸热”).
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:A极:2H2+2O2--4e-═2H2O B极:O2+4e-═2O2-则A极是电池的负极;电子从该极流出(填“流入”或“流出”).
(3)(a)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片上发生的电极反应Zn-2e-=Zn2+;银片上发生的电极反应2H++2e-=H2↑
(b)若以上电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:①产生氢气的体积(标准状况)4.48L;②消耗的锌的质量13g.(已知NA=6.02×1023 mol-1,)
分析 (1)利用太阳能分解海水是将太阳能转化为化学能;氢氧燃料电池属于原电池,是将化学能转化为电能,断裂化学键需要吸收能量,形成化学键放出能量;
(2)原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流出;
(3)(a)锌片、银片、稀硫酸构成原电池,活泼金属锌作负极,负极上失电子发生氧化反应,银作正极,正极上得电子发生还原反应,据此写出电极反应式;
(b)根据得失电子守恒计算生成氢气的体积.
解答 解:(1)科学家利用太阳能使海水分解,所以是太阳能转变为化学能,该反应中二氧化钛作催化剂;生成的氢气用于燃料电池时是把化学能转变为电能,水分解时,断裂的化学键是H-O键;电解水是吸热反应,
故答案为:催化剂、化学、电、吸热;
(2)A极是失去电子发生氧化反应的电极,所以A极是负极,正极上得电子发生还原反应,所以电子从负极流出,故答案为:负;流出;
(3)(a)锌片、银片、稀硫酸构成原电池,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+;银作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;
(b)该原电池中,负极上锌失电子变成锌离子进入溶液,导致质量减少,正极上金属不参加反应,所以该装置中减少的质量是锌的质量,根据转移电子相等知,生成氢气的物质的量和锌的物质的量相等,所以生成气体的体积=$\frac{(60-47)g}{65g/mol}$×22.4L/mol=4.48L,所以参加反应锌的质量为
$\frac{4.48}{22.4}×65$g=13g,故答案为:4.48L,13g.
点评 本题考查原电池反应的原理,负极发生氧化反应,正极发生还原反应,在得失电子守恒的情况下根据电极反应进行计算,难度不大.

①煤、石油、天燃气是当今世界最重要的化石能源
②电力、风力、生物质能均是可能再生的一次能源
③吸热反应发生时可能不要加热,放热反应发生时也可能需要加热
④等质量的糖类在体内发生氧化还原反应和在体外燃烧均生成CO2和液态水时,放出的能量不可能相等
⑤充电电池可以无限制地反复放电、充电.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①③ | D. | ①③④⑤ |
 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
①微粒半径:S2->Cl->S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
| A. | 只有③ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
| A. | H2、I2、HI共存 | |
| B. | 单位时间内生成n mol H2,同时生成n mol I2 | |
| C. | 单位时间内生成2n mol HI,同时生成n mol I2 | |
| D. | H2、I2、HI的 物质的量浓度比为1:1:2 |
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
②H2(g)=$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ•mol-1
据此判断下列说法正确的是( )
| A. | H2(g)=$\frac{1}{2}$O2(g)=H2O(I)△H>-241.8kJ•mol-1 | |
| B. | H2的燃烧热△H=-241.8 kJ.mol-1 | |
| C. | H2(g)转变成H2O(g)的化学反应一定放出能量 | |
| D. | CO(g)+H2O(g)=CO2(g)+H2(g)的△H=-41.2kJ•mol-1 |
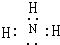 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
. .
.