题目内容
15.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图1所示的实验装置(支撑用的铁架台省略),按要求回答问题.(B中装的是无水硫酸铜)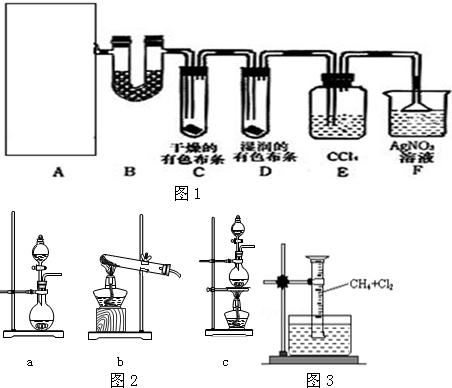
(1)A是氯气发生装置,实验室制取Cl2的原理是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O(用化学方程式表示)
(2)该实验中A部分的装置是图2中c(填字母)
(3)若用含有0.2mol HCl的浓盐酸与足量的氧化剂反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是浓盐酸的浓度随着反应的进行变稀以后,将不再反应,加热时浓盐酸因挥发而损失
(4)装置E的作用是吸收氯气.
(5)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.该装置中应放入湿润的淀粉KI试纸试剂.
(6)用如图3所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成.
①该反应的反应类型为取代反应;
②该反应的化学方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;(只写第一步)
③水槽中盛放的液体应为C(填标号);
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液.
分析 (1)二氧化锰在加热条件下能够氧化浓盐酸,生成氯气、氯化锰和水;
(2)依据反应物状态和反应条件选择合适的发生装置;
(3)只有浓盐酸才能与二氧化锰发生反应,稀盐酸不反应;
(4)氯气易溶于有机溶剂;
(5)氯气具有强的氧化性,能够氧化碘离子生成单质碘,单质碘遇到淀粉变蓝,用来检验 氯气是否被吸收完全;
(6)氯气与甲烷在光照条件下发生取代反应,水槽中的液体必须满足:氯气在该溶液中溶解度很小,以便证明氯气与甲烷发生了反应.
解答 解:(1)二氧化锰与浓盐酸加热生成氯气、氯化锰和水,化学方程式:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,故答案为:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O;
(2)实验室制备氯气用反应物状态为固体+固体,反应条件为加热,所以应选择装置c,故答案为:c;
(3)加热时部分浓盐酸挥发,加上随着反应的进行,盐酸不断消耗,浓度变稀,不再与二氧化锰反应,所以制得的氯气小于理论产量;
故答案为:浓盐酸的浓度随着反应的进行变稀以后,将不再反应;加热时浓盐酸因挥发而损失;
(4)四氯化碳为有机溶剂,氯气易溶于有机溶剂,可以用来吸收氯气,故答案为:吸收氯气;
(5)氯气与碘化钾反应生成单质碘,碘与淀粉变蓝,用湿润的淀粉碘化钾试纸检验氯气是否吸收完全,故答案为:湿润的淀粉KI试纸;
(6)①甲烷与氯气的反应属于取代反应,故答案为:取代反应;
②甲烷中一个氢原子被氯气取代的反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl;
③Cl2+H2O?H++Cl-+HClO,氯气在饱和氯化钠溶液中的溶解度较小,所以防止氯气和水反应,水槽中盛放的液体最好为饱和食盐水;由于氯气在水中溶解度较大、氯水能够与饱和石灰水、饱和碳酸氢钠溶液反应,干扰的实验结果,而不能使用水,更不能使用饱和石灰水、饱和碳酸氢钠溶液,故答案为:C.
点评 本题考查了氯气的制备及性质检验,注意掌握甲烷的化学性质及甲烷与氯气发生取代反应的原理,明确物质检验的严密性是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | H2O | B. | H3O+ | C. | CH4 | D. | CO2 |
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为[Co(Br)(NH3)5]SO4,中心离子的配位数为6.
(3)参考下表中的物质熔点回答下列问题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
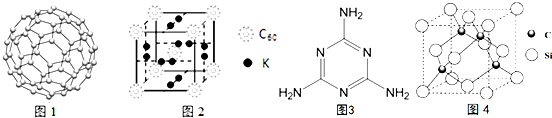
(4)C60可用作储氢材料.C60的结构如图1.已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确不正确,并阐述理由C60是分子晶体,熔化时不需破坏化学键.科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为3:1.
 σ
σ(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为$\frac{2π({b}^{3}+{c}^{3})}{3{a}^{3}}$×100%.(用含a、b、c的式子表示).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | A | |||||||
| 二 | D | F | H | |||||
| 三 | B | C | E | G |
(1)单质中氧化性最强的是F2,其电子式是
 ;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是
;化学性质最不活泼的是Ne,A与D形成的阳离子的电子式是 .
.(2)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列成序是NaOHAl(OH)3H3PO4HClO4;
(3)B元素可以形成两种氧化物,分别写出两种氧化物的电子式
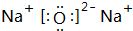 ,
,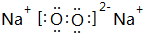 .其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移.
.其中B元素的原子与氧原子按1:1的个数比形成的化合物11.7g与足量二氧化碳完全反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2,有0.15mol 电子发生转移. 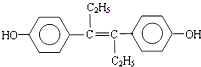 乙烯雌酚是一种激素类药物,结构简式如图.
乙烯雌酚是一种激素类药物,结构简式如图. .
.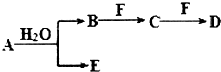 A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)
A、B、C、D、E、F为中学化学中的常见物质,且物质A由l~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:(请用具体的元素符号及化学用语作答)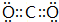 ;D的化学式为NaHCO3.
;D的化学式为NaHCO3. ,D属于共价化合物(填“共价”或“离子”);
,D属于共价化合物(填“共价”或“离子”);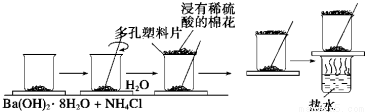
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.