12.下表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素分别为(写元素符号)ANa、BK、CMg、DAl、EC、FO、GCl、HBr、RAr,其中化学性质最不活泼的是Ar;
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程 .
.
(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
10.下列说法正确的是( )
| A. | 决定反应速率的因素只有催化剂 | |
| B. | 食物放在冰箱中会减慢食物变质的速率 | |
| C. | 锌与稀硫酸反应时,加入少量水能加快产生氢气的速率 | |
| D. | 在一定条件下2mol SO2与 1mol O2混合一定能生成2mol SO3 |
9.100 mL 1 mol•L-1的盐酸与锌粒反应,下列措施能使反应速率加快的是( )
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
7.下列关于铷(Rb)的叙述正确的是( )
| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
6.元素X的原子获得3个电子或Y的原子失去了2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下反应产物的化学式为( )
| A. | Y3X2 | B. | X2Y3 | C. | X3Y3 | D. | Y2X3 |
5.某化学兴趣小组同学以TiO2和CCl4为原料在实验室制取液态TiCl4,装置如图所示.

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
请回答下列问题:
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.
0 168091 168099 168105 168109 168115 168117 168121 168127 168129 168135 168141 168145 168147 168151 168157 168159 168165 168169 168171 168175 168177 168181 168183 168185 168186 168187 168189 168190 168191 168193 168195 168199 168201 168205 168207 168211 168217 168219 168225 168229 168231 168235 168241 168247 168249 168255 168259 168261 168267 168271 168277 168285 203614

有关信息如下:
①反应原理:TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$ TiCl4(g)+CO2(g)
②反应条件:无水无氧且加热
③有关物质性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管,其中装的试剂不可能是(填序号)B.
A.碱石灰 B.无水硫酸铜 C.氧化钙 D.烧碱
(2)整个实验过程中通N2的目的是排除装置中的空气,保证反应在无水无氧环境下进行.
(3)装置E中的试剂是浓硫酸;兴趣小组的甲同学认为实验中E装置不能换成A装置,理由是A装置不能吸收空气中的氧气,不能保证反应在无氧环境下进.
(4)实验开始前的操作包括:组装仪器、检查装置的气密性、加装药品、通N2一段时间后点燃酒精灯.
(5)欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(6)TiCl4还可由TiO2和焦炭、氯气在加热下反应制得,同时有CO产生,反应的化学方程式为TiO2+2Cl2+2C $\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+2CO;反应所需氯气可通过电解饱和食盐水制得,现电解1L饱和食盐水,当转移的电子数为0.1NA时,该溶液的pH值为13.
 图为原电池的示意图.请回答:
图为原电池的示意图.请回答: 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.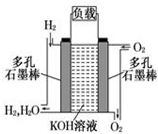 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回