题目内容
8.与NH${\;}_{4}^{+}$具有相同电子总数和质子总数的是( )| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
分析 NH4+的质子总数为11,电子总数为10;Na+的质子总数为11,电子总数为10;F-的质子总数为9,电子总数为10;Ne的质子总数为10,电子总数为10;K+的质子总数为19,电子总数为18.
解答 解:NH4+的质子总数为11,电子总数为10;
A.Ne的质子总数为10,电子总数为10,故A错误;
B.F-的质子总数为9,电子总数为10,故B错误;
C.Na+的质子总数为11,电子总数为10,故C正确;
D.K+的质子总数为19,电子总数为18,故D错误.
故选C.
点评 本题考查电子总数和质子总数的判断,难度不大,要注意粒子中电子总数和质子总数的关系.

练习册系列答案
相关题目
19.某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1mol该氧原子质量为aNAg | ||
| C. | xg该氧原子所含的电子数为8xNA | D. | yg该氧原子的中子数一定为$\frac{8y}{a}$ |
16.下列说法正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氨气是弱电解质,铜是强电解质 | |
| C. | 氧化钠是强电解质,醋酸是弱电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
13.某小组要探究卤族元素的非金属性强弱,设计了如下实验,请按要求填空.
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象 溶液分层下层为紫红色 | 写出试管①中的离子方程式: Cl2+2Br-=2Cl-+Br2 |
| 2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式: Br2+2I-=2Br-+I2 |
| 实验结论: 元素非金属性由强到弱的顺序为:Cl>Br>I. | ||
17.下列关于元素周期表中“短周期”的叙述中不正确的是( )
| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
18.下列有关晶体的说法正确的是( )
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
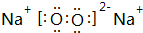 .
.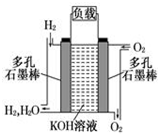 如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回
如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒.根据所学知识试回 ,A和E元素形成的化合物所含有的化学键是离子键.
,A和E元素形成的化合物所含有的化学键是离子键.