题目内容
6.元素X的原子获得3个电子或Y的原子失去了2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下反应产物的化学式为( )| A. | Y3X2 | B. | X2Y3 | C. | X3Y3 | D. | Y2X3 |
分析 元素X的原子获得3个电子与氖原子的电子层结构相,即有10个电子,则X原子有7个电子为N元素,元素Y的原子失去2个电子后,与氖原子的电子层结构相同,则Y原子有12个电子,则Y为Mg元素;根据它们的化合价判断.
解答 解:元素X的原子获得3个电子与氖原子的电子层结构相,即有10个电子,则X原子有7个电子为N元素,
元素Y的原子失去2个电子后,与氖原子的电子层结构相同,则Y原子有12个电子,则Y为Mg元素;
N与Mg形成化合物,N为-3价,Mg为+2价,则形成的化合物为:Mg3N2.
故选A.
点评 本题考查了原子结构和性质,题目难度不大,侧重于核外电子层结构和化合价的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
②稀溶液中,H+(aq)+OH一(aq)=H2O(1)△H=-57.3kJ•mol-1.
下列结论正确的是( )
| A. | 碳的燃烧热为110.5kJ.mo1-1 | |
| B. | 反应①的反应热为221 kJ.mo1-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1 mo1水时放出热量大于57.3 kJ | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成l mo1水时放出57.3 kJ的热量 |
14.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 75 | 74 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Y的最高价氧化物对应的水化物显两性 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | X、Y元素的金属性 X<Y | |
| D. | X2+离子半径大于W2-离子半径 |
1.下列属于吸热化学反应的是( )
| A. | 液态水气化 | B. | 醋酸的电离 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
16.下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)F元素在周期表中的位置是第三周期第ⅢA族.
(2)分别写出BA4、EG的电子式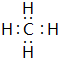 、
、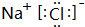
(3)用电子式表示离子化合物E2D、BD2的形成过程: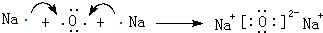 、
、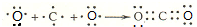
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
| A | |||||||
| B | C | D | |||||
| E | F | G | |||||
(2)分别写出BA4、EG的电子式
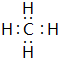 、
、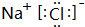
(3)用电子式表示离子化合物E2D、BD2的形成过程:
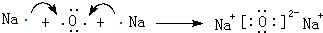 、
、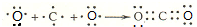
(4)F、G的最高价氧化物对应的水化物分别是Al(OH)3、HClO4;二者反应的离子方程式是Al(OH)3+3H+=Al3++3H2O.
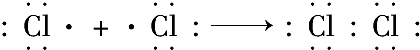 含有非极性键
含有非极性键 →
→ 含有极性键键
含有极性键键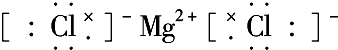 含有离子键
含有离子键 含有极性键、非极性键
含有极性键、非极性键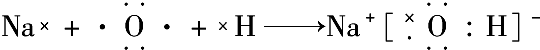 含有离子键、极性键.
含有离子键、极性键.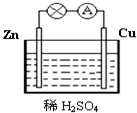 图为原电池的示意图.请回答:
图为原电池的示意图.请回答: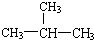
 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.回答下列问题: