题目内容
4. 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.(1)曲线Y(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若升高温度,则v(正)加快,v(逆)加快.(填“加快”或“减慢”).
(3)上述反应未达到平衡时,V正(X)>V逆(Y)(填<,>或=)
(4)在0到1min中内用X表示该反应的速率是0.15mol/(L.min),该反应达限度时,Y的转化率60%,反应开始时与反应达平衡状态时的压强之比为14:11.
(5)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是放热 反应.(填“放热”或“吸热”.已知:降低温度有利于放热反应)
分析 (1)根据图知,随着反应进行,X的物质的量增大、Y的物质的量减小,所以X是生成物、Y是反应物,反应达到平衡时,△n(X)=(0.7-0.4)mol=0.3mol,△n(Y)=(1-0.4)mol=0.6mol,参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y的计量数之比=0.3mol:0.6mol=1:2;
(2)升高温度,正逆反应速率都加快;
(3)X是四氧化二氮、Y是二氧化氮,反应过程中,X的反应速率小于Y反应速率;
(4)v=△nV△t△nV△t;转化率=参加反应的物质的量初始物质的量×100;恒温、恒容下,气体的物质的量之比等于其压强之比;
(5)升高温度,平衡向吸热反应方向移动.
解答 解:(1)根据图知,随着反应进行,X的物质的量增大、Y的物质的量减小,所以X是生成物、Y是反应物,反应达到平衡时,△n(X)=(0.7-0.4)mol=0.3mol,△n(Y)=(1-0.4)mol=0.6mol,参加反应的各物质的物质的量之比等于其计量数之比,所以X、Y的计量数之比=0.3mol:0.6mol=1:2,根据方程式知,Y表示NO2的物质的量随时间的变化曲线,故答案为:Y;
(2)升高温度,活化分子百分数增大,分子之间碰撞机会增大,所以正逆反应速率都加快,故答案为:加快;加快;
(3)X是四氧化二氮、Y是二氧化氮,反应过程中,平衡向生成四氧化二氮的方向移动,所以V正(X)>V逆(Y),故答案为:>;
(4)v=△nV△t=0.3mol2L1min=0.15mol/(L.min);转化率=参加反应的物质的量初始物质的量×100=0.6mol1mol×100=60%;恒温、恒容下,气体的物质的量之比等于其压强之比,反应前混合气体物质的量=(1+0.4)mol=1.4mol,反应后混合气体物质的量=(0.4+0.7)mol=1.1mol,所以反应前与平衡时压强之比=1.4mol:1.1mol=14:11,
故答案为:0.15mol/(L.min);60%;14:11;
(5)升高温度,平衡向吸热反应方向移动,气体颜色加深,说明平衡生成二氧化氮方向移动,则正反应是放热反应,故答案为:放热.
点评 本题考查图象分析,侧重考查学生分析判断及计算能力,涉及反应速率、转化率的计算及化学反应速率影响因素等知识点,明确图象中曲线含义及变化趋势是解本题关键,易错题是(4)题压强的计算.

| A. | ClCH2COOH的酸性比CH3COOH酸性强 | |
| B. | 丙酮分子(CH3COCH3)中的氢原子比乙烷分子中的氢原子更易发生卤代反应 | |
| C. | HOOCCH2CHO既能发生银镜反应又能发生酯化反应 | |
| D. | 苯酚能与NaOH溶液反应而乙醇则不能 |
| A. | 金刚石比石墨稳定 | B. | 石墨和金刚石是碳元素的同位素 | ||
| C. | 1mol石墨比1mol金刚石的总能量高 | D. | 金刚石转化为石墨属于化学变化 |
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
| A. | 只含碳元素 | B. | 只含氧元素 | ||
| C. | 一定含碳、氢元素,可能含氧元素 | D. | 只含碳、氧两种元素 |
| A. | 原子序数是24 | |
| B. | 最高价氧化物是SeO3,是酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物化学式是H2Se,稳定性比HCl差 |
 、DCH4、ECH3CH3.
、DCH4、ECH3CH3.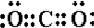 NaCl
NaCl H2O2
H2O2
 NH3:3H•+
NH3:3H•+ →
→ .
. (1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
(1)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O