题目内容
12.下表列出了A-R 9种元素在周期表中的位置:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
分析 (1)由元素在周期表中位置,可知A为Na,B为K元素,C为Mg,D为Al,E为C元素,F为O元素,G为Cl,H为Br,R为Ar;稀有气体化学性质最不活泼;
(2)D元素、A元素的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,二者反应生成偏铝酸钠与水;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;
(4)F元素的简单氢化物是水;不同元素原子之间形成的共价键为极性键;常温下,钾与是反应生成KOH与氢气;
(5)H元素跟A元素形成化合物为溴化钠,含有钠元素,高温灼烧该化合物时,火焰呈黄色,属于离子化合物,由钠离子与溴离子构成,用Na原子、Br原子电子式表示其形成过程;
(6)非金属性越强,氢化物越稳定、最高价含氧酸的酸性越强.
解答 解:(1)由元素在周期表中位置,可知A为Na,B为K元素,C为Mg,D为Al,E为C元素,F为O元素,G为Cl,H为Br,R为Ar;稀有气体Ar原子最外层为稳定结构,其化学性质最不活泼,
故答案为:Na; K;Mg;Al;C;O;Cl;Br;Ar;Ar;
(2)D元素、A元素的最高价氧化物对应的水化物分别为Al(OH)3、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg,
故答案为:K>Na>Mg;
(4)F元素氢化物是H2O,O原子与H原子之间形成极性键,常温下,钾与是反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,
故答案为:H2O;极性键;2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物是溴化钠,化学式为NaBr,含有钠元素,高温灼烧该化合物时,火焰呈黄色,属于离子化合物,由钠离子与溴离子构成,用Na原子、Br原子电子式表示其形成过程为 ,
,
故答案为:NaBr;黄; ;
;
(6)同主族自上而下,非金属性减弱,非金属性越强,氢化物越稳定、最高价含氧酸的酸性越强,故氢化物稳定性HCl>HBr,酸性:HClO4>HBrO4,
故答案为:HCl;HClO4.
点评 本题考查元素周期表与元素周期表综合应用,比较基础,注意对元素周期表的整体把握,有利于基础知识的巩固.

| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
 .下列有关氯化铵的叙述中,正确的是( )
.下列有关氯化铵的叙述中,正确的是( )| A. | 属于离子化合物 | B. | 属于共价化合物 | C. | 只含有离子键 | D. | 只含有共价键 |
| A. | 酯化反应、硝化反应以及酯的水解均属于取代反应类型 | |
| B. | 乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 | |
| C. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸和乙醇 | |
| D. | 甲烷、苯都属于烃,都不存在同分异构体 |
| A. | 水和酒精 | B. | 溴乙烷和水 | C. | 溴苯和水 | D. | 苯和水 |
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
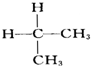 与
与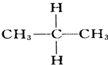
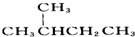 与
与