题目内容
9.100 mL 1 mol•L-1的盐酸与锌粒反应,下列措施能使反应速率加快的是( )①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
分析 增大盐酸与锌粒的反应速率,可通过外界条件对化学反应速率的影响来考虑,可增大浓度、升高温度,增大固体的表面积等因素来实现.
解答 解:①适当升高温度,增大活化分子百分数,反应速率加快,故①正确;
②改用100mL 3mol/L盐酸,酸的浓度增大,反应速率加快,故②正确;
③多用300mL 1mol/L盐酸,酸的浓度不变,反应速率不变,故③错误;
④用等量锌粉代替锌粒,增大固体接触面积,使反应速率加快,故④正确;
故选D.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合运用的考查,难度不大,注意相关基础知识的积累,把握影响化学反应速率的因素.

练习册系列答案
相关题目
19.短周期元素W、X、Y的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质.根据以上叙述,下列说法中一定正确的是( )
| A. | 上述三种元素的原子半径大小为Y<X<W | |
| B. | W、X、Y原子的核外最外层电子数的总和为10 | |
| C. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y只能形成含极性共价键的化合物 |
20.下列有关物质性质的说法中,错误的是( )
| A. | 硫是一种黄色晶体,易溶于水 | |
| B. | 新制氯水应避光保存 | |
| C. | 新制氯水具有漂白作用 | |
| D. | 二氧化氮是红棕色、有刺激性气味的有毒气体 |
17.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | 含有共价键的化合物一定是共价化合 |
18.填写下表:
| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
19.下列各组分子中,都属于含有极性键的非极性分子的是( )
| A. | HCl和NH3 | B. | BeCl2和N2 | C. | CH4和C2H4 | D. | CS2和H2O |
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.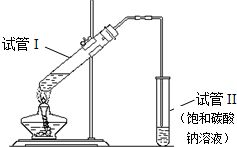 用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:
用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.