题目内容
7.下列关于铷(Rb)的叙述正确的是( )| A. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| B. | 硝酸铷是离子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氢氧化铷是弱碱 |
分析 铷最外层有1个电子,有5个电子层,位于第ⅠA族第五周期,属于碱金属,同主族元素性质具有相似性和递变 性,依据钠、钾性质推测铷的性质,据此解答.
解答 解:A.碱金属从上到小熔点依次减弱,所以铷的熔点低于钠、钾,故A错误;
B.硝酸铷是由铷离子与硝酸根离子构成离子化合物,故B正确;
C.铷最外层有1个电子,有5个电子层,位于第ⅠA族第五周期,故C错误;
D.碱金属从上到下对应氧化物水化物碱性依次增强,铷位于钾,所以氢氧化铷碱性强于氢氧化钾,是强碱,故D错误;
故选:B.
点评 本题考查了铷的性质,熟悉同主族性质递变规律和相似性是解题关节,题目难度不大.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
18.X、Y、Z都是短周期元素,X原子的最外层只有l个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有2种正价,两种正价的差值为2.由X、Y、Z三种元索组成的化合物的化学式可能是( )
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4.
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4.
| A. | ①②③ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①③⑤ |
2.下列说法正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 非极性键只存在双原子分子中 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
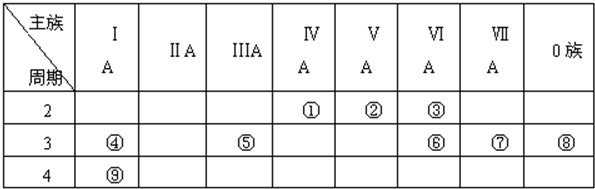
12.下表列出了A-R 9种元素在周期表中的位置:
(1)这9种元素分别为(写元素符号)ANa、BK、CMg、DAl、EC、FO、GCl、HBr、RAr,其中化学性质最不活泼的是Ar;
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程 .
.
(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素的简单氢化物的化学式是H2O,该氢化物含有的化学键是极性键(填极性键或非极性键),该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G和H元素的氢化物稳定的是(写化学式)HCl.G和H的最高价氧化物对应的水化物的酸性较强的是(写化学式)HClO4.
16.X、Y均为短周期元素,X原子的最外层有2个电子,Y原子的最外层有6个电子,这两种元素形成的化合物的化学式是( )
| A. | XY2 | B. | X2Y3 | C. | X2Y | D. | XY |
17.下列分子中,所有原子都满足最外层8电子稳定结构的是( )
| A. | CCl4 | B. | BeCl2 | C. | BF3 | D. | HClO |
 .
.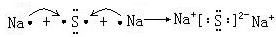 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.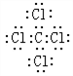 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.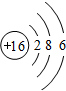 .
.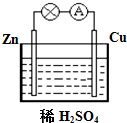 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: