2.下列说法中不正确的是( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
10.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是
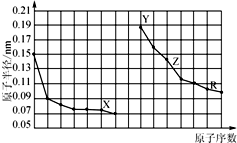

| A. | 同周期元素中,X的气态氢化物最稳定 | |
| B. | Y、Z的单质在空气中加热,均发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z. |
9.能在水溶液中大量共存的一组离子是( )
| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |
8.常温下,下列说法错误的是( )
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①>② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
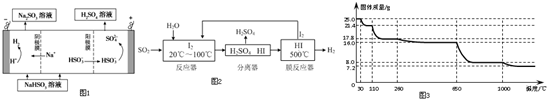
7.按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )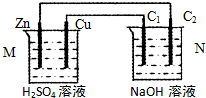

| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
6.下列说法正确的是( )
0 168074 168082 168088 168092 168098 168100 168104 168110 168112 168118 168124 168128 168130 168134 168140 168142 168148 168152 168154 168158 168160 168164 168166 168168 168169 168170 168172 168173 168174 168176 168178 168182 168184 168188 168190 168194 168200 168202 168208 168212 168214 168218 168224 168230 168232 168238 168242 168244 168250 168254 168260 168268 203614
| A. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| B. | 油脂在酸性条件下的水解反应称为皂化反应 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | CH3CH2OH与CH3CO18OH发生酯化反应所得混合液中,18O原子只存在于水分子中 |
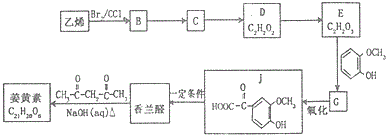

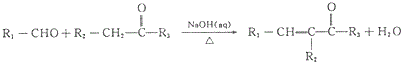 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)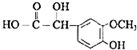 .经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为
.经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为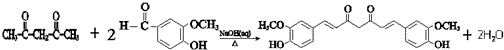 .
.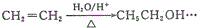
 $→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+
$→_{ⅱZn/H_{2}O}^{ⅰO_{3}}$ R1CHO+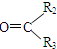
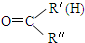 $\stackrel{一定条件下}{→}$ R-
$\stackrel{一定条件下}{→}$ R-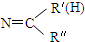 +H2O
+H2O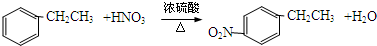 .
.

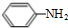 .
.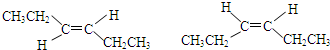 .
.