题目内容
10.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是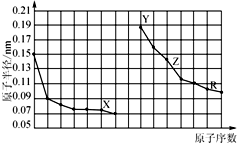
| A. | 同周期元素中,X的气态氢化物最稳定 | |
| B. | Y、Z的单质在空气中加热,均发生燃烧反应 | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z. |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素.
A.X为O元素,非金属性比F弱,第二周期中HF的稳定性最强,故A错误;
B.Al在空气中不能燃烧,会有红热现象,故B错误;
C.Y、Z、R对应的最高价氧化物的水化物分别为:NaOH、Al(OH)3、H2SO4,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硫酸反应,故C正确;
D.工业上电解熔融的Al2O3冶炼Al,故D正确;
故选AB.
点评 本题考查位置结构性质的关系及应用,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
相关题目
1.水是制取氢气的常见原料,下列说法正确的是( )
| A. | H3O+的空间构型为三角锥形 | |
| B. | 冰中存在氢键,液态水中不存在氢键 | |
| C. | 冰晶体中,1mol水分子可形成4mol氢键 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
18.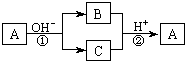 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
( )
 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如图的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
| A. | X元素可能为Al | B. | X元素一定为非金属元素 | ||
| C. | 反应①和②互为可逆反应 | D. | 反应①和②不可能都为氧化还原反应 |
2.下列说法中不正确的是( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎完全相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素的原子
⑤一种元素不可以形成不同的单质
⑥某种元素的相对原子质量取整数,就是其质量数.
| A. | ①②⑤⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
9.一种燃料电池,以镍板为电极插入KOH溶液,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+$\frac{7}{2}$O2+14e-=14OH-.有关推断不正确的是( )
| A. | 通氧气的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 电池工作一段时间后,KOH的物质的量浓度减小 | |
| D. | 电池工作时,溶液中OH-离子向正极移动 |
6.元素砹(At)原子序数为85,下面关于该元素说法不正确的是( )
| A. | AgAt 不溶于水 | |
| B. | HAt很不稳定 | |
| C. | At的单质是白色固体 | |
| D. | 该元素位于元素周期表第六周期、第十七列 |
7.下列有关化学用语正确的是( )
| A. | 氯化氢分子的电子式: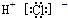 | |
| B. | H2O的结构式:H-O-H | |
| C. | 硫原子的结构示意图: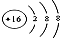 | |
| D. | 原子核内有8个中子的氧原子:${\;}_{8}^{18}$O |

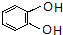 ,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).
,C的系统命名是3-溴丙烯(或3-溴-1-丙烯).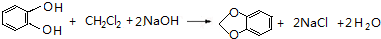 (或
(或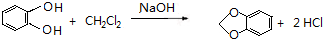 ).
).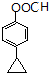 或
或 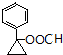 (任写一种).
(任写一种).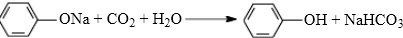 .
.