题目内容
8.常温下,下列说法错误的是( )| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①>② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
分析 A.根据硫酸氢钠溶液中的电荷守恒判断;
B.水的离子积与温度有关,温度不变,则水的离子积不变;
C.醋酸的酸性大于次氯酸,则醋酸钠的水解程度小于次氯酸根离子,pH相同时,醋酸钠浓度较大;
D.根据亚硫酸钠溶液中的物料守恒判断.
解答 解:A.pH=6的NaHSO4溶液中,根据电荷守恒可得:c(Na+)+c(H+)=2c(SO42-)+c(OH-),故A正确;
B.0.1 mol/L NaHCO3溶液加水稀释后,由于温度不变,则c(H+)与c(OH-)的乘积不变,故B正确;
C.pH相同的①CH3COONa、②NaClO二种溶液,由于次氯酸根离子的水解程度大于醋酸根离子,溶液pH相同时次氯酸钠溶液的浓度小于醋酸钠,故溶液中钠离子浓度大小为:①>②,故C正确;
D.0.1mol/L Na2SO3溶液中,根据物料守恒可得:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3)=0.2mol/L,故D错误;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
18.推理是一种重要的思维方法.下列推理合理的是( )
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
19. 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
 氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )
氮、磷、砷为同主族元素,该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质是( )| A. | 稳定性 | B. | 沸点 | C. | R-H键长 | D. | 分子间作用力 |
16.下列离子方程式中书写不正确的是( )
| A. | 少量二氧化硫与苛性钠溶液反应:SO2+2OH-=SO32-+H2O | |
| B. | 过量稀盐酸加入纯碱中:CO32-+2H+=H2O+CO2↑ | |
| C. | 铜粉与稀硫酸溶液反应:Cu+2H+=Cu2++H2↑ | |
| D. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
3.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物.请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
| A. | ZnC2水解生成乙烷(C2H6 ) | B. | Al4C3水解生成丙炔(C3H4) | ||
| C. | Mg2C3水解生成丙炔(C3H4) | D. | Li2C2水解生成乙烯(C2H4) |
7.下列各组微粒半径的排列顺序正确的是( )
| A. | Na<Si<P | B. | O2->Mg2+>Al3+ | C. | Ca>Ba>Ca2+ | D. | Cl->F>F- |
5.氮化硼是一种新合成的结构材料,具有超硬、耐磨、耐高温的特点.下列各组物质熔化时,所克服的微粒间作用力与氮化硼熔化所克服的微粒间作用力相同的是( )
| A. | 氯化钠 | B. | 碳酸氢钠 | C. | 干冰 | D. | 二氧化硅 |


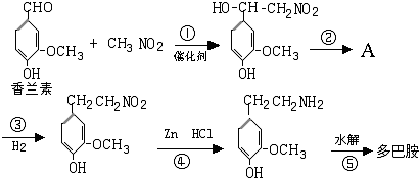
 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子) .经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为
.经测定姜贡素的分子中有2个甲基,则香兰醛生成姜黄素的化学方程式为 .
.

 .
.
 .
.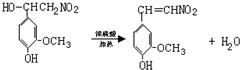 .
.