题目内容
7.按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )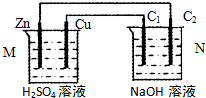
| A. | 工作一段时间后装置M、N中溶液pH均增大 | |
| B. | M装置中H+移向Zn电极 | |
| C. | C2上发生氧化反应 | |
| D. | Cu电极与C1电极发生的电极反应相同 |
分析 由图可知,M构成原电池,Zn为负极,Cu为正极,;N为电解池,C1为阳极,氢氧根离子在阳极放电生成氧气,C2为阴极,氢离子在阴极放电生成氢气,结合电极反应及原电池反应、电解反应来解答.
解答 解:A、M构成原电池,电池反应为Zn+2H+═Zn2++H2↑,氢离子浓度减小pH增大,N装置中两个电极均为石墨棒,N中发生2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,NaOH浓度增大,pH增大,故A正确;
B、原电池中阳离子移向正极Cu,故B错误;
C、C2为阴极,氢离子在阴极放电生成氢气,发生还原反应,故C错误;
D、Cu电极上氢离子放电生成氢气,C1为阳极,氢氧根离子在阳极放电生成氧气,故D错误;
故选A.
点评 本题考查原电池及电解原理,明确装置是解答本题的关键,并熟悉工作原理及电极反应来解答,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
17.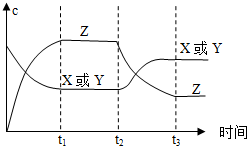 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
 已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )
已知X(g)+Y(g)?2Z(g)△H<0.反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件是下列说法中正确的是( )| A. | 升高温度 | B. | 减小Z的浓度 | C. | 增大压强 | D. | 增大X或Y的浓度 |
18.下列关于丙炔(CH3-C≡CH)的说法正确的是( )
| A. | 丙炔分子中不存在非极性键 | |
| B. | 丙炔分子中3个碳原子都是sp3杂化 | |
| C. | 丙炔分子中所有的原子都在同一直线上 | |
| D. | 丙炔分子中σ键与π键的个数比为3:1 |
15.某无色溶液中加入氢氧化铝固体,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、NO3-、Cl- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Ca2+、K+、SO32-、NO3- | D. | Na+、K+、Cu2+、Br- |
2. 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
 中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )| A. | 是一种烃 | B. | 属于高分子化合物 | ||
| C. | 属于芳香族化合物 | D. | 分子式是C15H22O5 |
6.下列关于元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 |
4.下列实验操作正确的是( )
| A. | 实验室制乙烯:将乙醇和浓H2SO4按1:3(体积比)混合(放碎瓷片),迅速升温至140℃ | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:1-溴丙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |
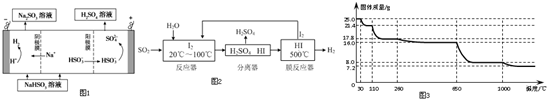
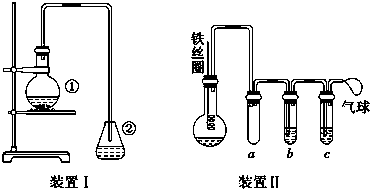
 .
.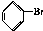 与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.
与Br2,要想得到纯净的产物,可用NaOH溶液或水试剂洗涤.