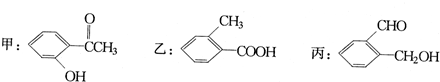
题目内容
9.能在水溶液中大量共存的一组离子是( )| A. | Fe2+、Mg2+、SO42-、NO3- | B. | Na+、Ag+、Br-、PO43- | ||
| C. | Ba2+、K+、SO32-、ClO- | D. | Al3+、NH4+、CO32-、Cl- |
分析 A.四种离子之间不发生反应,能够大量共存;
B.银离子与溴离子、磷酸根离子反应生成沉淀;
C.次氯酸根离子能够氧化亚硫酸根离子,钡离子与亚硫酸根离子反应生成亚硫酸钡;
D.铝离子与碳酸根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.Fe2+、Mg2+、SO42-、NO3-之间不反应,在溶液中能够大量共存,故A正确;
B.Ag+与Br-、PO43-发生反应生成沉淀,在溶液中不能大量共存,故B错误;
C.SO32-、ClO-之间发生氧化还原反应,Ba2+、SO32-之间反应生成亚硫酸钡,在溶液中不能大量共存,故C错误;
D.Al3+、CO32-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.H、C、N、O、Na、Cr是常见的六种元素.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
(3)25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s)△H=-414kJ•mol-1
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
20. BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
 BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )
BF3与一定量的水可形成(H2O)2•BF3晶体,结构如图所示则(H2O)2•BF3晶体中各种微粒间的作用力不涉及( )| A. | 共价键 | B. | 离子键 | C. | 配位键 | D. | 范德华力 |
17.某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{Am}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
8.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )
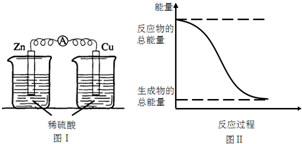

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 图II所示的反应为吸热反应 |
5.下列说法中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 在周期表里,主族元素所在的族序数等于原子核外电子数 |
6.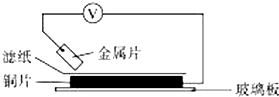 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
 将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )
将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表.已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大.请依据记录数据判断,下列有关说法正确的是( )| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
| A. | 在四种金属中C的还原性最弱 | |
| B. | 金属B能从硫酸铜溶液中置换出铜 | |
| C. | AD若形成原电池时A为正极 | |
| D. | AB形成合金时,将该合金露置在空气中,A先被腐蚀 |