20.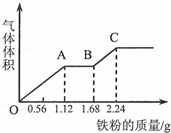 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
19.己知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H1,②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2
下列推断正确的是( )
下列推断正确的是( )
| A. | 若CO的燃烧热为△H3,则H2的燃烧热为△H3-△H1 | |
| B. | 反应CH4(g)+CO2(g)═2CO(g)+2H2(g)的△H=△H${\;}_{{\;}_{2}}$-△H1 | |
| C. | 若反应②的反应物总能量低于生成物总能量,则△H2<0 | |
| D. | 若等物质的量的CO和H2完全燃烧生成气态产物时前者放热更多,则△H1>0 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
17.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所对应的离子方程式正确的是
( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
16.乙烷与氯气在光照条件下发生取代反应所得有机物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
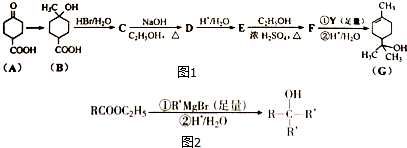
14.铜和铜的化合物是重要的化工原料,常用作催化剂、防腐剂和消毒剂等制备合成.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):(见图1)

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
(4)氯和钾与不同价态的铜可形成两种化合物M和N,二都均可用于催化乙炔聚合,二者阴离子均为无限长链结构(见图2),下列分析正确的是BC.
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).
13. 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为2NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | NaBH4是一种重要的储氢载体,1molNaBH4与水反应[NaBH4+2H2O=NaBO2+4H2↑]时转移的电子数目为8NA | |
| D. | 常温下,1L0.2mol/L的盐酸溶液通人氨气当溶液pH=7,则溶液中NH4+数为0.2NA |
11.下列有关实验叙述正确的是( )
0 167880 167888 167894 167898 167904 167906 167910 167916 167918 167924 167930 167934 167936 167940 167946 167948 167954 167958 167960 167964 167966 167970 167972 167974 167975 167976 167978 167979 167980 167982 167984 167988 167990 167994 167996 168000 168006 168008 168014 168018 168020 168024 168030 168036 168038 168044 168048 168050 168056 168060 168066 168074 203614
| A. | 除去苯中混有少量的苯酚可加人浓溴水后过滤 | |
| B. | 向酸性KMnO4溶液中滴加维生素C溶液,KMnO4溶液裉色,说明维生素C具有还原性 | |
| C. | 在淀粉溶液中加稀硫酸并加热后,加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 | |
| D. | 将Na2SO3溶液蒸干,灼烧至恒重,最终剩余固体是Na2SO3 |
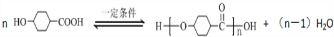 ;
; .
.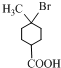 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr.