题目内容
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
分析 A、求出氢氧化钠的物质的量,然后根据1molNaOH含20mol电子来分析;
B、乙烷所处的状态不明确;
C、C0、N2的摩尔质量均为28g/mol;
D、溶液体积不明确.
解答 解:A、4g氢氧化钠的物质的量为0.1mol,而1molNaOH含20mol电子,故0.1mol氢氧化钠中含2mol电子,即2NA个,故A正确;
B、乙烷所处的状态不明确,不一定是标况,故乙烷的物质的量不一定是1mol,含有的化学键不一定是7mol,故B错误;
C、C0、N2的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,则含有的分子数为0.5NA个,故C错误;
D、溶液体积不明确,NH4+与Cl-数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
9.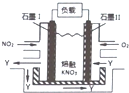 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
6.当前我国环境状况不荣乐观,其中PM2.5、CO、SO2、NOx等污染物对空气质量的影响非常显著,其主要来源为燃煤、机动车尾气等,因此,对其进行研究具有重要意义,请回答下列问题:
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算该试样的pH=4.
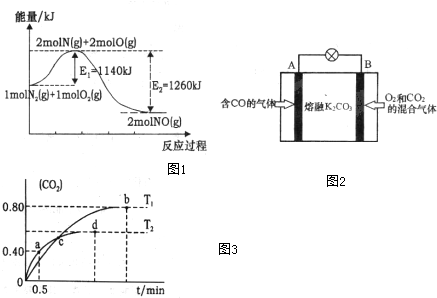
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)
(1)对某地PM2.5样本用蒸馏水处理后,测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图1如下:
①写出N2和O2反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=-120kJ•mol-1.
②处理尾气时,加装催化转化装置使NOx与CO转变为无污染的气体排放,请写出该反应的化学方程式2NOx+2xCO$\frac{\underline{\;催化剂\;}}{\;}$N2+2xCO2
③有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g)△H>0,请你分析该设想能否实现?不能(填“是”或“否”),依据是该反应是焓增、熵减的反应,根据G=△H-T•△S,G>0.
④另有人认为以如图2所示原电池原理也可以除去CO,则其正极反应式为O2+2CO2+4e-=2CO32-.容器中的CO32-离子A极移动(填“A”或“B”).
(3)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2的体积分数随时间t变化曲线如图3.请回答下列问题:
①T1时化学平衡常数K=1024
②下列说法正确的是AD(填字母序号).
A.容器内气体密度不变,表明反应达到平衡状态
B.该反应的△H>0
C.d点时,向恒容容器中充入2molCO,再次平衡后,CO2的含量增大.
D.T1与T2化学平衡常数大小关系:K(T1)>K(T2)

13.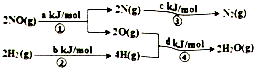 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
7.空气的成分中,体积分数约占 78%的是( )
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 稀有气体 |
8.下列离子方程式书写正确的是( )
| A. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH2.H2O | |
| B. | 高锰酸钾酸性溶液吸收二氧化硫:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ | |
| C. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
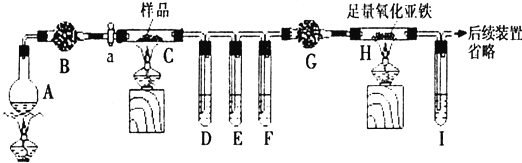
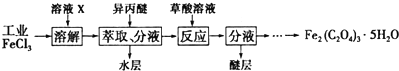
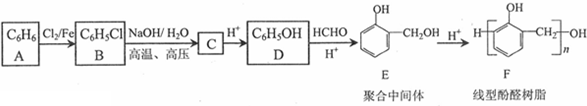
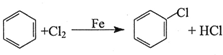 ,反应类型为取代反应
,反应类型为取代反应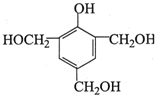
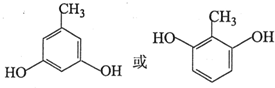 (写出其中一种的结构简式);
(写出其中一种的结构简式);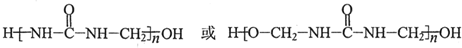 .
.