题目内容
20.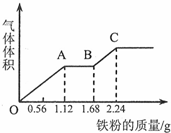 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
分析 由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,最后溶液溶质为硫酸亚铁,结合反应的离子方程式以及题给相关数据解答该题.
解答 解:A.反应消耗2.24g铁,其物质的量为$\frac{2.24g}{56g/mol}$=0.04mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以硫酸为0.04mol,所以硫酸的浓度为:$\frac{0.04mol}{0.1L}$=0.4mol/l,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(HNO3)=n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,
n(H+)=2n(H2SO4)+n(HNO3)=0.04mol×2+0.02mol=0.1mol,c(H+)=$\frac{0.1mol}{0.1L}$=1mol/L,pH=0,故A错误;
B.由以上分析可知,OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O,故B正确;
C.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,故C正确;
D.OA段硝酸根离子全部反应,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段溶液中有氢离子与铁反应,发生反应为:Fe+2H+=Fe2++H2↑,故D正确.
故选A.
点评 本题以图象为载体考查混合物反应的计算,题目难度中等,据图象分析各段发生的反应原理为解答关键,注意与铁的反应中硝酸全部起氧化剂作用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 信息产业中光纤的主要成分是单质硅 | |
| B. | 碳酸氢钠可用于制备纯碱,作治疗胃酸过多的药物及食品发酵剂 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 医学上,血液透析是利用了胶体的渗析原理 |
11.下列说法不正确的是( )
| A. | 着火时应立即灭火,一般的小火应用湿布、石棉布或沙子覆盖燃烧物,衣服着火时应迅速脱下衣服或用石棉布覆盖着火处 | |
| B. | 乙酸乙酯中少量乙醇杂质可加水除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 取5 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1FeCl3溶液5~6滴,再加入2 mL CCl4,充分振荡后静置,取上层溶液滴加KSCN溶液,溶液变色 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |
8.下列排列顺序错误的是( )
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
5.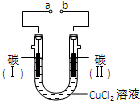 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )| A. | a为电源正极 | B. | 电极Ⅱ上发生还原反应 | ||
| C. | 电子流向:a→Ⅰ→Ⅱ→b | D. | 该装置将电能转化为化学能 |
9.近年来,我市多地出现了较为严重的雾霾天气,从而再次引起人们对空气质量的关注,下列一些行为和举措,有利于改善空气质量的是( )
| A. | 燃放烟花爆竹 | B. | 大力发展火力发电 | ||
| C. | 露天焚烧垃圾 | D. | 提高电动汽车的比例 |
10.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 0.1mol白磷(P4)所含的共价键数目为0.4 NA | |
| C. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为7NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
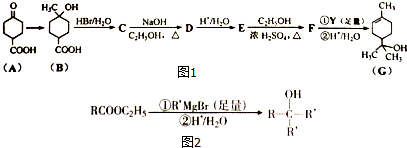
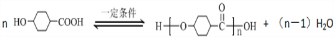 ;
; .
. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2H2O+NaBr.
+2H2O+NaBr. Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途.