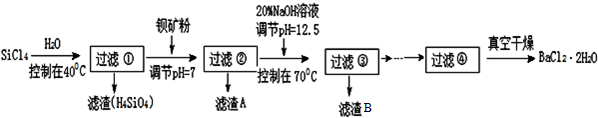
题目内容
13.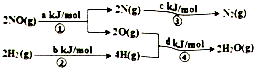 用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )
用H2可将工业废气中的NO催化还原化N2,其能量转化关系如图:(图中计量单位为mol),则:NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H为( )| A. | 0.5•(a+b-c-d)kJ/mol | B. | 0.5•(c+a-d-b)kJ/mol | ||
| C. | 0.5•(c+d-a-b)kJ/mol | D. | 0.5•(c+d-a-b)kJ/mol |
分析 由图中转化可知,断裂化学键吸收能量,形成化学键释放能量,发生2NO(g)+2H2(g)=N2(g)+2H2O(l)△H=(a+b-c-d)kJ•mol-1,化学反应中化学计量数与反应中的能量变化成正比,以此计算.
解答 解:由图中转化可知,断裂化学键吸收能量,形成化学键释放能量,发生2NO(g)+2H2(g)=N2(g)+2H2O(l)△H=(a+b-c-d)kJ•mol-1,
又化学计量数与反应中的能量变化成正比,则NO(g)+H2(g)═0.5N2(g)+H2O(g)的△H=0.5•(a+b-c-d)kJ/mol,
故选A.
点评 本题考查反应热的计算,为高频考点,把握化学键与能量变化的关系及化学计量数与反应中能量变化的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
3.某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量.采取的主要操作如图,能达到实验目的是( )
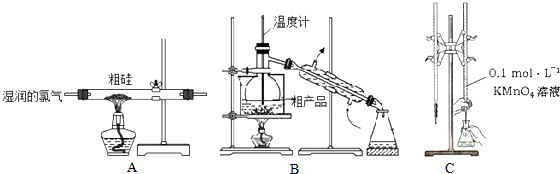

| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |
8.下列排列顺序错误的是( )
| A. | 键能:C≡C>C=C>C-C | B. | 键长:C-C>C=C>C≡C | ||
| C. | 沸点:C5H8>C4H6>C3H4 | D. | 分子活性:C2H6>C2H4>C2H2 |
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
5.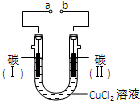 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
 实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )
实验室用图所示装置电解氯化铜溶液,实验中观察到碳(I)电极质量增加,碳(II)电极有气体放出.下列说法正确的是( )| A. | a为电源正极 | B. | 电极Ⅱ上发生还原反应 | ||
| C. | 电子流向:a→Ⅰ→Ⅱ→b | D. | 该装置将电能转化为化学能 |
2.下列有关Na2S溶液的叙述正确的是( )
| A. | 该溶液中,SO2、Cl- K+、HCO3-可以大量共存 | |
| B. | 和FeCl3溶液反应的离子方程式:S2-+Fe3+═Fe2++S | |
| C. | 和少量盐酸反应的离子方程式:S2-+H+═HS- | |
| D. | 1L0.1mol•L-1该溶液和足量硫酸铜溶液反应生成16.0克Cu2S |
3.治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:NO2+NO+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O.某学生在实验室用一定量的铜与足量的硝酸反应,收集到标准状况下NO、NO2和N2O4的混合气体共aL.若将上述混合气体通入1L 1mol/L的NaOH溶液中恰好被完全吸收.下列分析错误的是( )
| A. | 11.2L<a<22.4L | |
| B. | 若a=16.8L,V(N2O4)=5.6L | |
| C. | 若a=16.8L,n(NaNO2):n(NaNO3)=4:1 | |
| D. | 若混合气体与NaOH溶液反应只生成一种盐,则n(NO)=0.5mol |
 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.