题目内容
17.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所对应的离子方程式正确的是| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | K+、Fe3+、NO3-、SO42- | 少量KSCN | Fe3++3SCN-=Fe(SCN)3 |
| B | Na+、AlO2-、Cl-、OH- | 过量NaHCO3 | OH-+HCO3-=CO32-+H2O |
| C | H+、Ba2+、Al3+、HCO3- | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | K+、Na+、S2O32-、Cl- | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该组离子之间不反应,加KSCN,与铁离子结合生成络离子;
B.该组离子之间不反应,但加过量NaHCO3,与AlO2-、OH-均反应;
C.该组离子之间结合生成水、气体、沉淀等;
D.该组离子之间不反应,但加过量硫酸发生氧化还原反应生成S、二氧化硫和水.
解答 解:A.该组离子之间不反应,可大量共存,且加KSCN,与铁离子结合生成络离子,离子反应为Fe3++3SCN-=Fe(SCN)3,故A正确;
B.该组离子之间不反应,但加过量NaHCO3,与AlO2-、OH-均反应,离子反应为OH-+HCO3-=CO32-+H2O、H2O+AlO2-+HCO3-=Al(OH)3↓+CO32-,故B错误;
C.H+、HCO3-结合生成水、气体,Al3+、HCO3-结合生成、沉淀,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,但加过量硫酸发生氧化还原反应生成S、二氧化硫和水,离子反应为S2O32-+2H+=SO2+S↓+H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、络合反应的离子反应考查,综合性较强,题目难度不大,选项B为解答的难点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
8.化学来源于生活,服务于生活,下列有关叙述正确的是( )
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 | |
| C. | 氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
5.硼和铝是同主族元素,在生产、生活和科研中具有广泛的应用.以下是几种常见的硼化合物:
请回答下列问题:
(1)写出硼元素在周期表中的位置第二周期ⅢA族.
(2)工业上以硼镁矿为原料制取硼,该工艺的中间过程会发生反应:B2O3+3Mg=2B+3MgO,则每生成1mol的硼转移的电子数为3NA.
(3)工业上常用金属铝冶炼难熔金属,请写出以五氧化二矾(V2O5)和铝为原料获得金属矾的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,请写出硼酸与氢氧化钠反应的离子方程式H3BO3+OH-=[B(OH)4]-.
(5)硼氢化钠(NaBH4)是一种强还原剂,遇水剧烈反应产生大量气体,请写出该反应的化学方程式NaBH4+2H2O═NaBO2+4H2↑.
(6)偏硼酸钠能溶于水,其溶液显碱性(填“酸性”、“中性”或“碱性”),原因是BO2-+2H2O?H3BO3+OH-(用离子方程式表示)
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5•H2O | Na2B4O7•10H2O | H3BO3 | NaBO2 |
(1)写出硼元素在周期表中的位置第二周期ⅢA族.
(2)工业上以硼镁矿为原料制取硼,该工艺的中间过程会发生反应:B2O3+3Mg=2B+3MgO,则每生成1mol的硼转移的电子数为3NA.
(3)工业上常用金属铝冶炼难熔金属,请写出以五氧化二矾(V2O5)和铝为原料获得金属矾的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(4)硼酸是一种一元弱酸,它与水作用时结合水电离的OH-而释放出水电离的H+,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,请写出硼酸与氢氧化钠反应的离子方程式H3BO3+OH-=[B(OH)4]-.
(5)硼氢化钠(NaBH4)是一种强还原剂,遇水剧烈反应产生大量气体,请写出该反应的化学方程式NaBH4+2H2O═NaBO2+4H2↑.
(6)偏硼酸钠能溶于水,其溶液显碱性(填“酸性”、“中性”或“碱性”),原因是BO2-+2H2O?H3BO3+OH-(用离子方程式表示)
12.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为2NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | NaBH4是一种重要的储氢载体,1molNaBH4与水反应[NaBH4+2H2O=NaBO2+4H2↑]时转移的电子数目为8NA | |
| D. | 常温下,1L0.2mol/L的盐酸溶液通人氨气当溶液pH=7,则溶液中NH4+数为0.2NA |
9.常温下,将pH=a的某一元酸HA溶液与pH=b的NaOH溶液等体积混合,充分反应.下列叙述一定正确的是( )
| A. | 若n(HA)=n(NaOH),则a+b≥14 | B. | 若n(HA)>n(NaOH),则a+b<14 | ||
| C. | 若混合后溶液pH=7,则n(HA)≥n(NaOH) | D. | 若混合后溶液pH>7,则n(HA)<n(NaOH) |
6.下列物质属于纯净物的是( )
| A. | 冰水 | B. | 海水 | C. | 盐水 | D. | 雨水 |
7.下列有关物质分类的说法中,正确的是( )
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
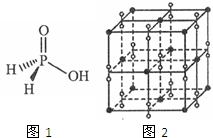 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.