20.化学与社会、环境、生活有密切联系,下列说法错误的是( )
| A. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 | |
| B. | 地下钢管连接锌块是采用牺牲阳极的阴极保护法 | |
| C. | 乳酸分子中既有羟基又有羧基,其缩聚产物聚乳酸是一种可降解的环保材料. | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型无机高分子材料 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
17.设nA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
16.下列关于有机物的说法正确的是( )
| A. | 石油的分馏和裂化均属于化学变化 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 糖类、蛋白质、合成橡胶都是高分子化合物 | |
| D. | 甲苯、乙烯、聚乙烯都能使酸性KMnO4溶液褪色 |
15.下列实验设计不合理的是( )
| A. | 比较相同条件下水解能力:室温下用pH计分别测量同浓度的Na2CO3和NaHCO3溶液的pH | |
| B. | 检验乙烯:无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾溶液,观察到溶液紫色很快褪去,证明反应生成了乙烯 | |
| C. | 检验铝热剂中铁的价态:将铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,证明该铝热剂不含氧化铁 | |
| D. | 在2mL同浓度的NaCl、NaI混合溶液中滴入几滴稀AgNO3溶液,观察到产生黄色沉淀,证明Ksp(AgCl)>Ksp(AgI) |
14.25℃时,下列有关物质的量浓度关系正确的是( )
| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
13.今年是门捷列夫诞辰180周年.如表是元素周期表的一部分,粗线是其边界.下列说法不正确的是( )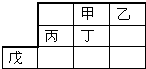

| A. | 最高价氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一种单质是自然界最硬的物质 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
12.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1mol氦气含有4nA个质子 | |
| B. | 1molNa2O2与足量CO2充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4LHCHO含有nA个分子 |
11.生活中处处有化学.下列说法不正确的是( )
0 167870 167878 167884 167888 167894 167896 167900 167906 167908 167914 167920 167924 167926 167930 167936 167938 167944 167948 167950 167954 167956 167960 167962 167964 167965 167966 167968 167969 167970 167972 167974 167978 167980 167984 167986 167990 167996 167998 168004 168008 168010 168014 168020 168026 168028 168034 168038 168040 168046 168050 168056 168064 203614
| A. | 令人讨厌的地沟油可以用于制肥皂 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
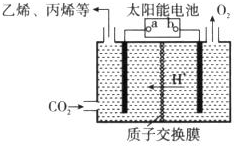
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.