题目内容
18.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
分析 A.pH=1的溶液为酸性溶液,偏铝酸根离子与酸性溶液中的氢离子反应;
B.铁离子能够氧化碘离子;
C.四种离子之间不发生反应,都不与硝酸根离子反应;
D.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.pH=l的溶液中存在大量氢离子,AlO2-与氢离子反应,在溶液中不能大量共存,故A错误;
B.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.H+、Na+、Fe3+、Cl-之间不反应,且都不与NO3-反应,在溶液中能够大量共存,故C正确;
D.Al3+、HCO3-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
8.电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示.下列有关说法错误的是( )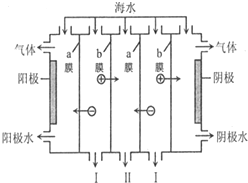

| A. | 阳极可发生电极反应:2Cl--2e-═Cl2↑ | |
| B. | 阴极附近溶液的pH减小 | |
| C. | a膜为阴离子交换膜,b膜为阳离子交换膜 | |
| D. | I、II分别是淡水、浓海水出口 |
13.今年是门捷列夫诞辰180周年.如表是元素周期表的一部分,粗线是其边界.下列说法不正确的是( )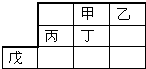

| A. | 最高价氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一种单质是自然界最硬的物质 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
3.常温下,下列关于电解质溶液的说法正确的是( )
| A. | pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等浓度的NaOH至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3••H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
10.下列各组物质中,化学键类型相同,化合物类型也相同的是( )
| A. | SO2和Na2SO4 | B. | CO2和H2O | C. | NaOH和NaCl | D. | KCl和HCl |
8.化学来源于生活,服务于生活,下列有关叙述正确的是( )
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致 | |
| B. | 冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 | |
| C. | 氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |