题目内容
20.化学与社会、环境、生活有密切联系,下列说法错误的是( )| A. | 泡沫灭火器的内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 | |
| B. | 地下钢管连接锌块是采用牺牲阳极的阴极保护法 | |
| C. | 乳酸分子中既有羟基又有羧基,其缩聚产物聚乳酸是一种可降解的环保材料. | |
| D. | 手机外壳上贴的碳纤维外膜是一种新型无机高分子材料 |
分析 A、硫酸铝水解使溶液显酸性,故硫酸铝溶液会与铁反应,应放在内筒里;
B.原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,牺牲负极保护正极的方法属于牺牲阳极的阴极保护法;
C.缩聚产物聚乳酸是羟基和羧基发生酯化反应缩聚得到的高聚物,酯键易发生水解;
D.碳纤维是一种新型的无机非金属材料.
解答 解:A、硫酸铝水解使溶液显酸性,故硫酸铝溶液会与铁反应,应放在内筒塑料桶里,外筒为铁桶,外筒和内筒之间装有碳酸氢钠溶液,故A错误;
B.锌块、铁和电解质溶液构成原电池时,锌块易失电子而作负极,铁作正极,作正极的金属被保护,牺牲负极保护正极的方法属于牺牲阳极的阴极保护法,故B正确;
C.缩聚产物聚乳酸是羟基和羧基发生酯化反应缩聚得到的高聚物,酯易水解,是一种可降解的环保材料,故C正确;
D.碳纤维是一种新型的新型无机高分子材料,故D正确;
故选A.
点评 本题主要考查了与生产、生活密切相关的化学知识,要求学生会运用化学知识解释生活现象,难度不大,注意对基础知识的把握.

练习册系列答案
相关题目
10.下列有机物的名称与结构简式相符的是( )
| A. | 石炭酸: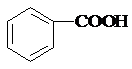 | B. | 甘油: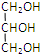 | C. | 蚁酸:CH3COOH | D. | 木精:CH3CH2OH |
11.下列说法正确的是( )
| A. | 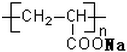 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 异丁烷的八氯代物共有4种(不考虑立体异构) |
8.甲苯的苯环上有5个氢原子,若其中两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物同分异构有( )
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
15.下列实验设计不合理的是( )
| A. | 比较相同条件下水解能力:室温下用pH计分别测量同浓度的Na2CO3和NaHCO3溶液的pH | |
| B. | 检验乙烯:无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾溶液,观察到溶液紫色很快褪去,证明反应生成了乙烯 | |
| C. | 检验铝热剂中铁的价态:将铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,证明该铝热剂不含氧化铁 | |
| D. | 在2mL同浓度的NaCl、NaI混合溶液中滴入几滴稀AgNO3溶液,观察到产生黄色沉淀,证明Ksp(AgCl)>Ksp(AgI) |
5.化学与生产、生活密切相关.下列说法的是( )
| A. | 小苏打是发酵粉的主要成分 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 向汽油中添加乙醇后,该混合燃料的热值不变 | |
| D. | 粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
12.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表.
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
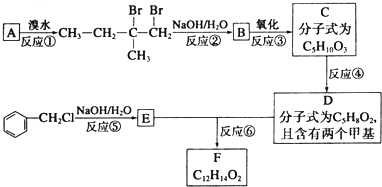
 .
. .
.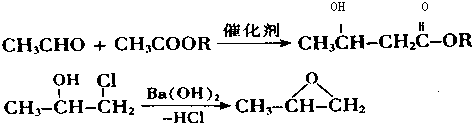
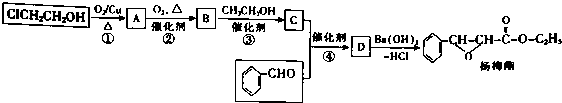
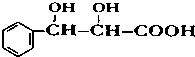 . 下列有关该物质的叙述中,正确的是CD.
. 下列有关该物质的叙述中,正确的是CD.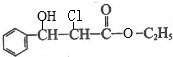 .
. 等.
等.