题目内容
14.25℃时,下列有关物质的量浓度关系正确的是( )| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
分析 A、物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性,说明A-离子水解程度大于HA的电离程度;
B、三种溶液的pH均相同,c(OH-)浓度相同,c(NaOH)=c(OH-),但碳酸的酸性小于醋酸的酸性,碳酸根离子水解程度大于醋酸根离子,所以c(Na2CO3)<c(CH3COONa);
C、pH=3的HCl和pH=11的氨水溶液中c(Cl-)=c(NH4+),等体积混合后,一水合氨又电离出铵根离子;
D、依据溶液中电荷守恒分析,阳离子所带正电荷总数等于阴离子所带负电荷总数;
解答 解:A、物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性,说明A-离子水解程度大于HA的电离程度,c(A-)<c(HA),故A正确
B、三种溶液的pH均相同,c(OH-)相同,c(NaOH)=c(OH-),但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3),所以三种溶液的pH均为9,则物质的量浓度的大小顺序是c(NaOH)<c(Na2CO3)<c(CH3COONa),故B错误;
C、pH=3的HCl和pH=11的氨水溶液中c(Cl-)=c(NH4+),等体积混合后,一水合氨又电离出铵根离子,c(Cl-)<c(NH4+),故C错误;
D、1.0mol/L Na2CO3溶液中存在电荷守恒:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)c(Na+)=2.0mol/L,2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L,故D正确;
故选AD.
点评 本题考查了电解质溶液中离子浓度大小比较,电荷守恒的分析应用,盐类水解原理的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
4.(1)前三周期元素中第一电离能最小的是Na(填元素符号),其基态原子的电子排布式为1s22s22p63s1.第二周期非金属元素形成的氢化物中化学键极性最大的是HF(填分子式),该物质在CCl4中的溶解度比在水中的溶解度小(填“大”或“小”).
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是B(填物质字母代号).
(3)晶格能的大小:MgO>NaCl,键能的大小:HBr>HI.(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是B
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异.根据下表数据,形成分子间氢键的物质是B(填物质字母代号).
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 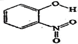 | 0.2 | 45 |
| B | 对-硝基苯酚 | 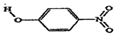 | 1.7 | 114 |
(4)下列物质的熔点高低顺序,正确的是B
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr.
2.分析下列实验操作,其中不能达到实验目的( )
| 序号 | 实验操作 | 实验目的 |
| ① | 将足量的SO2气体通入装有品红溶液的试管中 | 研究SO2具有漂白性 |
| ② | 向盛有10molAgNO3溶液的试管中滴加几滴NaCl溶液,再向其中滴加几滴Na2S | 比较Ksp(AgCl)与Ksp(Ag2S)的大小 |
| ③ | 测定等物质的量浓度HCl,HNO3的pH | 比较Cl,N的非金属性强弱 |
| ④ | 向2支试管中加入同体积通浓度的H2C2O4溶液,再分别加入同体积不同浓度的酸性KMnO4 | 研究浓度对反应速率的影响 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
6.25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11.下列说法正确的是( )
| A. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 | |
| B. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 | |
| C. | 25℃时,在CaCO3悬浊液中加人NaF固体,CaCO3全部溶解 | |
| D. | 25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
3.某实验小组利用粗硅与氯气反应生成SiCl4粗产品(含有FeCl3、AlCl3等杂质且SiCl4遇水极易水解),蒸馏得四氯化硅(SiCl4的沸点57.7℃),再用氢气还原制得高纯硅;用滴定法测定蒸馏后残留物(将残留物预处理成Fe2+)中铁元素含量.采取的主要操作如图,能达到实验目的是( )


| A. | 用装置A完成SiCl4的制备 | |
| B. | 用装置B进行蒸馏提纯SiCl4 | |
| C. | 用装置C进行滴定达终点时现象是:锥形瓶内溶液变为紫红色且半分钟内不变色 | |
| D. | 配制0.1 mol•L-1KMnO4溶液定容摇匀后,发现液面低于刻度线,加水至刻度线 |

 .
.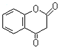 互为同分异构体且同时符合下列条件的有机物的结构简式为
互为同分异构体且同时符合下列条件的有机物的结构简式为
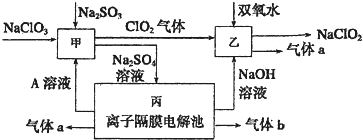
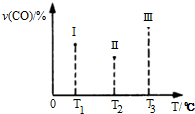 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.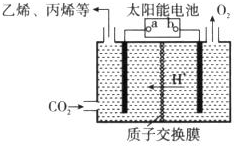
 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.