题目内容
12.设nA为阿伏加德罗常数的数值.下列说法正确的是( )| A. | 常温常压下,1mol氦气含有4nA个质子 | |
| B. | 1molNa2O2与足量CO2充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4LHCHO含有nA个分子 |
分析 A.氦气是单原子分子,1mol氦气含有1molHe原子,含2mol质子;
B.1mol过氧化钠完全反应生成0.5mol氧气,过氧化钠中氧元素的化合价为-1价;
C.硫酸溶液中,硫酸和水分子中都含有H原子,漏掉了水分子中的氢原子;
D.标况下,甲醛为气体,可以使用标况下的气体摩尔体积计算.
解答 解:A.1mol氦气含有1molHe原子,含2mol质子,含有2nA个质子,故A错误;
B.1mol过氧化钠与二氧化碳完全反应生成0.5mol氧气,转移了1mol电子,转移了2nA个电子,故B错误;
C.49gH2SO4的物质的量为:$\frac{49g}{98g/mol}$=0.5mol,0.5mol硫酸中含有1mol氢原子,溶液中的水分子也含有H原子,则溶液中含有的H原子数大于nA,故C错误;
D.标况下,甲醛为气体,22.4L甲醛的物质的量为1mol,含有nA个甲醛分子,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系为解答关键,A、C为易错点,注意稀有气体为氮原子分子、硫酸溶液中的水分子也含有H原子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列有关描述正确的是( )
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 石油化工中的裂化、裂解过程都是通过化学反应来获得气态烯烃 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
7.下列药品和装置合理且能完成相应实验的是( )
| A. |  检验装置气密性 | B. |  收集气体 | ||
| C. | 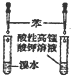 验证苯中不含有碳碳双键 | D. |  实验室制取并收集氨气 |
17.设nA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
1.根据反应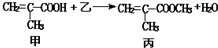 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )
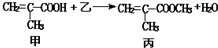 判断下列说法中不正确的是( )
判断下列说法中不正确的是( )| A. | 乙物质为甲醇 | |
| B. | 该反应为取代反应 | |
| C. | 甲与乙都能与金属钠反应产生氢气 | |
| D. | 甲、乙、丙都能与溴的四氯化碳溶液发生加成反应 |
2.常温下,满足甲组中的任意一种物质均能与乙组中任意一种物质发生反应的是( )
| 选项 | 甲组 | 乙组 |
| A | Al(OH)3、稀盐酸 | NaOH溶液、氨水 |
| B | O2、N2 | H2、Mg |
| C | Cu、NaOH溶液 | FeCl3溶液、稀硝酸 |
| D | SiO2、Cl2 | HF、H2SO3 |
| A. | A | B. | B | C. | C | D. | D |
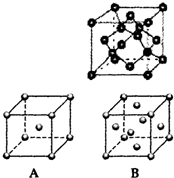 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题: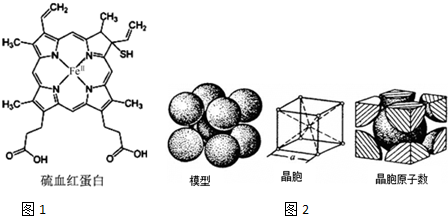
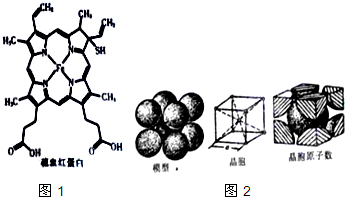 血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题:
血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题: