题目内容
13.今年是门捷列夫诞辰180周年.如表是元素周期表的一部分,粗线是其边界.下列说法不正确的是( )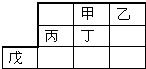
| A. | 最高价氧化物水化物的酸性:乙>丁 | |
| B. | 甲的一种单质是自然界最硬的物质 | |
| C. | 戊元素位于第4周期第 VⅢ族 | |
| D. | 乙、丙的最高价氧化物的水化物可以反应 |
分析 由元素在周期表中位置,可知甲为C、乙为N、丙为Al、丁为Si、戊为Zn.
A.非金属性越强,最高价含氧酸的酸性越强;
B.金刚石的硬度最大;
C.戊元素位于第4周期第ⅡB族;
D.乙、丙的最高价氧化物的水化物分别为硝酸、氢氧化铝,氢氧化铝是两性氢氧化物,能与强酸、强碱反应.
解答 解:由元素在周期表中位置,可知甲为C、乙为N、丙为Al、丁为Si、戊为Zn.
A.非金属性N>Si,非金属性越强,最高价含氧酸的酸性越强,故A正确;
B.碳元素的单质中金刚石是自然界最硬的物质,故B正确;
C.戊元素位于第4周期第ⅡB族,故C错误;
D.乙、丙的最高价氧化物的水化物分别为硝酸、氢氧化铝,二者反应生成硝酸铝与水,故D正确,
故选:C.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表,注意对元素周期律的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
1.化学与生活息息相关,下列说法不正确的是( )
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不同 | |
| C. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
8.甲苯的苯环上有5个氢原子,若其中两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物同分异构有( )
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
18.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
5.化学与生产、生活密切相关.下列说法的是( )
| A. | 小苏打是发酵粉的主要成分 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 向汽油中添加乙醇后,该混合燃料的热值不变 | |
| D. | 粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
2.常温时,将0.1mol Fe(NO3)3和2mol HCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色.下列有关说法正确的是( )
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
3.已知H2C2O4是二元弱酸,NaHC2O4溶液显酸性.25℃时,将a mol•L-1H2C2O4溶液与b mol•L-1NaOH溶液等体积混合(0<a≤0.1,0<b≤0.1),下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | a=b时,c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-) | |
| B. | a=$\frac{b}{2}$时,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| C. | a=2b时,2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| D. | a=3b时,c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
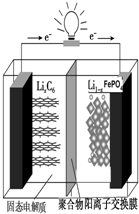 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4