题目内容
17.设nA表示阿伏加德罗常数的数值,下列有关说法正确的是( )| A. | 1 mol Cu和足量的硫反应,转移的电子数为nA | |
| B. | 标准状况下,22.4 L氯仿中含有的分子数为nA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1nA | |
| D. | 53.5g NH4Cl中含有的分子数为NA |
分析 A.铜与硫反应生成Cu2S,硫化铜中铜为+1价;
B.标况下,氯仿为液体;
C.溶液体积不知,不能计算微粒数;
D.离子晶体不存在分子.
解答 解:A.铜与硫反应生成Cu2S,1 mol Cu和足量的硫反应生成0.5molCu2S,转移的电子数为NA,故A正确;
B.标况下,氯仿为液体,不能使用气体摩尔体积,故B错误;
C.溶液体积不知,不能计算微粒数,故C错误;
D.氯化铵为离子晶体,不存在分子,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用、微粒个数的计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意离子晶体、原子晶体都不存在分子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.紫苏醇的结构简式如图所示.下列有关紫苏醇的说法正确的是( )


| A. | 与乙醇互为同系物 | |
| B. | 一定条件下能与乙酸发生酯化反应 | |
| C. | 存在属于芳香族化合物的同分异构体 | |
| D. | 能与溴水、酸性高锰酸钾溶液发生加成反应 |
8. 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl$?_{放电}^{充电}$2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl${\;}_{4}^{-}$-3e-=4Cl-+Al |
5.下列坐标图均涉及到平衡原理,其中相关( )
| A. |  如图表示室温下,用0.1mol•L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3•H2O),虚线表示c(NH${\;}_{4}^{+}$),处于M点时溶液呈中性 | |
| B. |  如图表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. |  如图表示反应2NH3(g)?3H2(g)+N2(g),在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 | |
| D. |  如图表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
12.设nA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1mol氦气含有4nA个质子 | |
| B. | 1molNa2O2与足量CO2充分反应转移了2nA个电子 | |
| C. | 含49gH2SO4的硫酸溶液中含有nA个氢原子 | |
| D. | 标准状况下,22.4LHCHO含有nA个分子 |
2.下列实验操作、现象和结论不正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃杯蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液可能是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 向酚酞溶液中加入过量的Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的 碱有漂白性 |
| D | 将表面氧化的铜丝从酒精灯的外焰慢慢移向内焰 | 黑色的铜丝变红 | CuO被内焰中的乙醇蒸气还原 |
| A. | A | B. | B | C. | C | D. | D |
6.下列装置或操作能达到实验目的是( )
| A. | 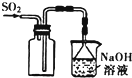 用图所示装置收集SO2气体 | |
| B. | 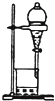 用图所示装置萃取碘水中的碘 | |
| C. | 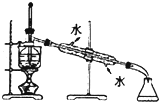 用图所示装置进行石油的分馏 | |
| D. | 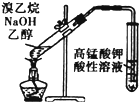 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
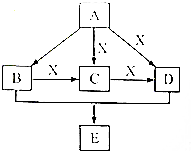 A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题:
A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题: ,工业上大量获得A的方法是石油裂解.
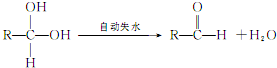
,工业上大量获得A的方法是石油裂解. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;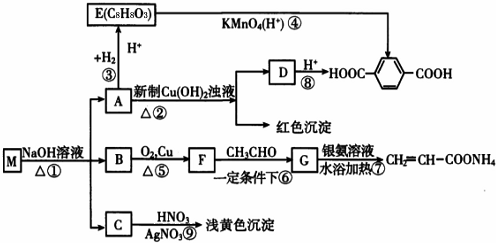
 ;
; ;
; ;
;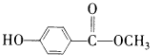 ,
,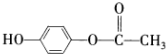 ?
?