9.H、C、N、Cl、Na、Al是常见的六种元素
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
(3)用电子式表示Na Cl的形成过程: .
.
(4)已知在常温常压下:
写出H2与Cl2反应的热化学方程式:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1;.
(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
8.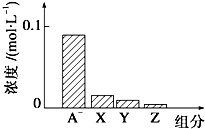 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA溶液显酸性 | |
| B. | 混合溶液中水电离出的C(OH-)、C(H+)相等 | |
| C. | 图中X、Y、Z分别代表OH-、HA-、H+ | |
| D. | 混合溶液中:C(Na+)=C(H2A)+C(HA-)+C(A2-) |
7.室温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
5.常温下,有关下列溶液的组成描述合理的是( )
| A. | 中性溶液中可能大量存在:Ca2+,Cl-,SO42-,K+ | |
| B. | 弱酸性溶液中可能大量存在:Cu2+,NH4+,NO3-,Cl- | |
| C. | 使石蕊试液变蓝的溶液中可能大量存在:Na+,Al3+,SO42-,NO3- | |
| D. | 水电离的c(OH-)=10-10mol/L溶液中可能大量存在:l-,NO3-,Mg2+,K+ |
4.下表中对应关系正确的是( )
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
2.100mL 5mol/L的氨水吸收一定量的SO2气体后,二氧化硫与氨水完全反应生成盐.向所得溶液中加入0.7mol Na2O2固体,充分反应后加热使气体全部逸出,收集到的干燥气体的平均相对分子质量可能为( )
| A. | 20 | B. | 21 | C. | 22 | D. | 23 |
1.向等物质的量浓度的MgSO4和NaHSO4的混合溶液中逐滴滴入一定量的Ba(OH)2溶液,下列离子方程式与事实不相符的是( )
0 167865 167873 167879 167883 167889 167891 167895 167901 167903 167909 167915 167919 167921 167925 167931 167933 167939 167943 167945 167949 167951 167955 167957 167959 167960 167961 167963 167964 167965 167967 167969 167973 167975 167979 167981 167985 167991 167993 167999 168003 168005 168009 168015 168021 168023 168029 168033 168035 168041 168045 168051 168059 203614
| A. | H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-=Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | 3Mg2++2H++4SO42-+4Ba2++8OH-=3Mg(OH)2↓+4BaSO4↓+2H2O |

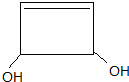 .
.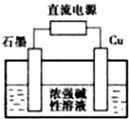 金属单质及其化合物在工农业生产中应用广泛.
金属单质及其化合物在工农业生产中应用广泛.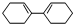 c.
c.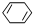 d.
d.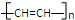
 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$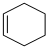 则要制备
则要制备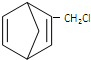 ,含共轭结构的原料可以是
,含共轭结构的原料可以是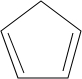 或
或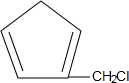 .(写结构简式)
.(写结构简式)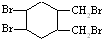 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).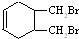 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$