题目内容
8.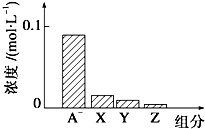 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA溶液显酸性 | |
| B. | 混合溶液中水电离出的C(OH-)、C(H+)相等 | |
| C. | 图中X、Y、Z分别代表OH-、HA-、H+ | |
| D. | 混合溶液中:C(Na+)=C(H2A)+C(HA-)+C(A2-) |
分析 NaHA和NaOH溶液等体积、等浓度0.2mol/L混合,NaHA+NaOH=Na2A+H2O,所得溶液中A2-浓度小于0.1mol/L,说明在溶液中存在A2-+H2O?HA-+OH-,A2-水解,Na2A溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(A-)>c(OH-)>c(HA-)>c(H+),即X表示OH-,Y表示HA-,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
A.NaHA为弱酸的酸式盐溶液可能显酸性,也可能显碱性;
B.该混合液pH>7;
C.X表示OH-,Y表示HA-,Z表示H+;
D.根据物料守恒分析.
解答 解:NaHA和NaOH溶液等体积、等浓度0.2mol/L混合,NaHA+NaOH=Na2A+H2O,所得溶液中A2-浓度小于0.1mol/L,说明在溶液中存在A2-+H2O?HA-+OH-,A2-水解,Na2A溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(A-)>c(OH-)>c(HA-)>c(H+),即X表示OH-,Y表示HA-,Z表示H+,溶液中存在物料守恒为:c(Na+)=c(A-)+c(HA).
A.NaHA为弱酸的酸式盐溶液,溶液中存在水解平衡和电离平衡,若电离程度大于水解程度,则显酸性,若水解程度大于电离程度,则显碱性,故A错误;
B.该混合液pH>7,则c(OH-)>c(H+),故B错误;
C.由分析可知,X表示OH-,Y表示HA-,Z表示H+,故C正确;
D.混合后发生反应为NaHA+NaOH=Na2A+H2O,则c(Na)=2c(A),即C(Na+)=2C(H2A)+2C(HA-)+2C(A2-),故D错误.
故选C.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒、电荷守恒分析解答,考查离子浓度大小比较、电离平衡和水解平衡的应用、盐类水解等,题目难度中等.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案①H+(aq)+OH-(aq)→H2O(l)+a kJ
②NH4+(aq)+H2O(l)H+(aq)+NH3•H2O(aq)+b kJ
③HAc(aq)+OH-(aq)→Ac-(aq)+H2O(l)+c kJ
则a、b、c的大小关系为( )
| A. | a>c>b | B. | a=b=c | C. | a=c>b | D. | a>c=b |
| A. | 氮肥 | B. | 磷肥 | C. | 钾肥 | D. | 复合肥 |
| A. | 甲苯的一氯代物有4中,甲苯与氢气完全加成后产物的一氯代物有5种 | |
| B. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 漂粉精和医用酒精均可用作消毒剂 |
| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
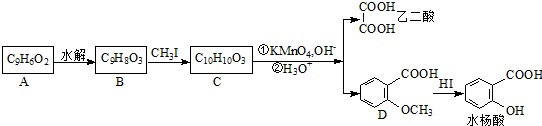
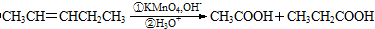
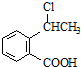
 .
. 可以最终合成芳香内酯A,其中前两步的反应是
可以最终合成芳香内酯A,其中前两步的反应是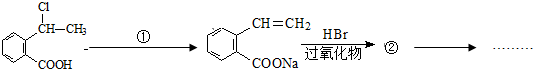
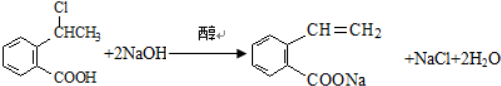 ,产物②的结构简式是
,产物②的结构简式是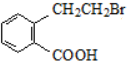 .
.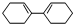 c.
c.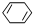 d.
d.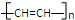
 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$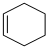 则要制备
则要制备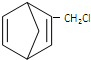 ,含共轭结构的原料可以是
,含共轭结构的原料可以是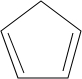 或
或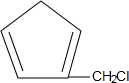 .(写结构简式)
.(写结构简式)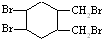 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).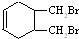 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$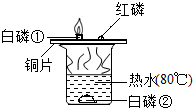 燃烧是我们非常熟悉的化学反应.
燃烧是我们非常熟悉的化学反应.