题目内容
6. 金属单质及其化合物在工农业生产中应用广泛.
金属单质及其化合物在工农业生产中应用广泛.(1)用FeC13溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是ac.
a.若无固体剩余,则溶液中可能有Fe3+
b.若有固体存在,则溶液中一定有Cu2+和Fe2+
c.若溶液中有Cu2+,则可能有固体存在,且该固体中一定没有铁粉
d.若溶液中有Fe2+,则一定有固体存在
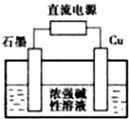
(2)Cu2O是一种半导体材料,制取Cu2O的电解池如图,则石墨电极接电源的负(填“正”或“负”)极,电解池工作时,Cu电极的电极反应式为2Cu-2e-+2OH-═Cu2O+H2O;电解后溶液pH变大(填“变大”、“变小”或“不变”),
(3)查阅资料可知:Cu2O为红色碱性氧化物,在酸性溶液中可发生反应:Cu2O+2H+=Cu+Cu2++H2O.请设计简单实验来验证某铜粉样品中是否有氧化亚铜:少许样品于试管中,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
分析 (1)FeCl3溶液腐蚀印刷电路板上的铜发生反应:Cu+2Fe3+=Cu2++2Fe2+,Fe3+ 氧化性强于Cu2+,加入铁粉先与Fe3+反应,再与Cu2+反应,据此解答;
(2)阳极上铜失电子发生氧化反应,阴极上氢元素得电子发生还原反应,据此分析;
(3)根据氧化亚铜和酸反应的生成物确定实验方法.
解答 解:(1)a.无固体剩余,说明铜全部以铜离子形式存在,加入的铁完全反应,溶液中一定含有Fe2+,可能含有Fe3+,故a正确;
b.若有固体存在,固体中一定有铜,可能有铁,溶液中一定有含有Fe2+,不一定有Cu2+,故b错误;
c.若溶液中有Cu2+,加入的铁量不足,可能只与Fe3+反应,也可能与Fe3+反应,剩余部分与Cu2+反应生成铜,所以可能有固体析出并且该固体中一定没有铁粉,故c正确;
d.当加入的铁较少时,只发生Fe+2Fe3+=3Fe2+时,不会有铜析出,故d错误;
故选:ac;
(2)根据阳极上铜失电子发生氧化反应生成氧化亚铜,Cu电极的电极反应式为2Cu-2e-+2OH-═Cu2O+H2O;阴极上氢元素得电子发生还原反应,电极反应式为2H2O+2e-═H2↑+2OH-,所以石墨电极是阴极,与阴极连接的电极是电源的负极,电解总反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑,则消耗水,所以碱性增强,电解后溶液pH变大,
故答案为:负;2Cu-2e-+2OH-═Cu2O+H2O;变大;
(3)铜离子在溶液中呈蓝色,氧化亚铜能和酸反应生成铜离子,溶液由无色变为蓝色;铜和弱氧化性的酸不反应,根据该物质能否和酸反应判断.
故答案为:取少许样品于试管中,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有.
点评 本题考查了铁及其化合物的性质以及电解原理,难度中等,熟悉三价铁离子、铜离子氧化性强弱以及反应的过程是解题的关键;

| A. | HCl | B. | 冰醋酸 | C. | Na2SO4 | D. | KOH |

| A. | 装置①常用于互溶但沸点不同的液体混合物的分离 | |
| B. | 用装置②可除去NO2中的NO | |
| C. | 装置③可用于吸收NH3或HCl气体,并防止倒吸 | |
| D. | 装置④可用于制备Fe(0H)2并能 较长时间观察其颜色 |
| A. | 分子晶体中一定含有共价键 | |
| B. | 离子晶体中一定含有离子键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有非极性键的分子一定是非极性分子 |
| A. | H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-=Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | 3Mg2++2H++4SO42-+4Ba2++8OH-=3Mg(OH)2↓+4BaSO4↓+2H2O |
| A. | 磨豆成浆 | B. | 剪纸成花 | C. | 酿谷成酒 | D. | 雕石成像 |
| A. | 向SO2水溶液中加入少量NaHCO3粉末,有气泡产生,说明SO2水溶液呈酸性 | |
| B. | 向SO2水溶液中滴加Ba(NO3)2溶液,有白色沉淀产生,说明SO2水溶液中含有SO42- | |
| C. | 将SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有氧化性 | |
| D. | 向KMnO4溶液中滴加SO2水溶液,溶液颜色褪去,说明SO2水溶液具有漂白性 |



