题目内容
9.H、C、N、Cl、Na、Al是常见的六种元素(1)H位于元素周期表第1周期第ⅠA族;C的基态原子核外有2对成对电子;
Cl原子的价电子表示式3S23P5.
(2)用“>”、“=”、“<”填空
| 稳定性 | 得电子能力 | 离子半径 | 电负性 |
| CH4<NH3 | 1H=2H | Na+>Al3+ | C>Al |
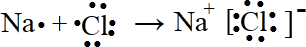 .
.(4)已知在常温常压下:
| 化学键 | H-H | H-Cl | Cl-Cl |
| 键能kJ/mol | a | b | c |
分析 (1)H的原子序数为1,原子结构中有1个电子层,最外层电子数为1;C的基态原子核外电子排布为2S22P2,所以有对成对电子;Cl原子的价电子表示式3S23P5;
(2)元素非金属性越强氢化物越稳定;最外层电子数相同所以得电子能力相同,电子层数相同是核电荷数越多半径越小,非金属性越强电负性越大;
(3)氯化钠是离子化合物,用电子式表示其形成过程时,左边是原子的电子式,右边为氯化钠的电子式,中间用箭头连接;
(4)化学反应的焓变值=|旧键断裂吸收的能量-新键生成释放的能量|.
解答 解;(1)H的原子序数为1,原子结构中有1个电子层,最外层电数为1;C的基态原子核外电子排布为2S22P2,所以有对成对电子;Cl原子的价电子表示式3S23P5;故答案为:1;ⅠA;2; 3S23P5;
(2)元素非金属性越强氢化物越稳定,而非金属性C<N,所以稳定性CH4<NH3;最外层电子数相同所以1H和2H得电子能力相同,电子层数相同是核电荷数越多半径越小,铝的核电荷数大,所以Na+>Al3+,非金属性越强电负性越大,碳的非金属性强于铝,所以碳的电负性大于铝,故答案为:<;=;>;>;
(3).NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,形成过程为: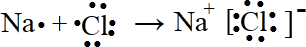 ,
,
故答案为: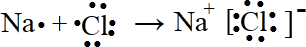 ;
;
(4)氢气和氯气反应时,旧键断裂吸收的能量:aKJ+ckJ=(a+c)kJ,新键生成释放的能量:bkJ×2=2bkJ,所以释放的热量高于吸收的热量,该反应是放热的,焓变△H=(a+c-2b)kJ•mol-1,
故答案为:H2(g)+Cl2(g)═2HCl(g)△H=(a+c-2b)kJ•mol-1.
点评 本题考查较综合,涉及元素周期表的结构及应用、元素非金属性的比较及应用等,注重高频考点的考查,题目难度不大

HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32-②
向0.1mol/L 的NaHSO3 溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | NaHSO3 溶液中,c(H2SO3)>c(SO32-),加水稀释后离子浓度均减小 | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的值增大 | |
| D. | 加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
| A. | 1:3 | B. | 3:2 | C. | 6:5 | D. | 4:3 |
| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
| A.由淀粉得到的酒精,Na2S溶液中存在的HS- | 均为水解反应生成 |
| B.C+CO2=2CO,3C+SiO2=SiC+2CO | 均为碳单质只作还原剂的氧化还原反应. |
| C.由Fe生成FeCl2或FeCl3,由Na生成Na2O或Na2O2 | 均可通过化合反应实现 |
| D.乙醇使酸性KMnO4溶液褪色,SO2使滴有酚酞的NaOH溶液褪色 | 均发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
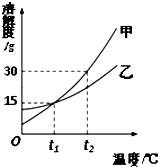 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 将甲的饱和溶液变为不饱和溶液可采用降温的方法 | |
| C. | t1℃时,甲、乙的饱和溶液中溶质的质量分数不一定相等 | |
| D. | t2℃时,将甲、乙等质量的饱和溶液降温至t1℃,甲析出的固体一定大于乙 |
| A. | Al3+的结构示意图: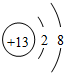 | B. | NaClO的电子式: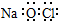 | ||
| C. | 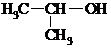 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | D. | 乙醛分子的比例模型: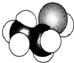 |
| A. | 2NO2?N2O4-----①N2O4?2NO2--②,反应①的化学平衡常数是反应②的化学平衡常数的倒数 | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol将0.05mol/LBa(OH)2溶液100.0mL与0.05mol/LH2SO4溶液100.0mL混合,在298K101kPa条件下放热量为0.573kJ | |
| C. | 已知298K 时,0.10mol/L HAc的电离度为1.32%.在0.10mol/L HAc 和0.10mol/LNaAc的混合溶液20.00mL中,有如下变化: HAc?H++Ac----①,NaAc=Na++Ac-----②,Ac-+H2O?HAc+OH-----③,向该溶液中滴入几滴稀盐酸,溶液的pH保持相对稳定 | |
| D. | 将明矾与纯碱溶液混合,有沉淀产生,该沉淀的成分为碳酸铝 |