题目内容
5.常温下,有关下列溶液的组成描述合理的是( )| A. | 中性溶液中可能大量存在:Ca2+,Cl-,SO42-,K+ | |
| B. | 弱酸性溶液中可能大量存在:Cu2+,NH4+,NO3-,Cl- | |
| C. | 使石蕊试液变蓝的溶液中可能大量存在:Na+,Al3+,SO42-,NO3- | |
| D. | 水电离的c(OH-)=10-10mol/L溶液中可能大量存在:l-,NO3-,Mg2+,K+ |
分析 A.钙离子与硫酸根离子反应生成微溶物硫酸钙;
B.四种离子之间不发生反应,铵根离子水解显示弱酸性;
C.使石蕊试液变蓝的溶液为碱性溶液,铝离子与氢氧根离子反应;
D.水电离的c(OH-)=10-10mol/L溶液为酸性或碱性溶液,酸性条件下硝酸根离子能够氧化碘离子,碱性条件下镁离子与氢氧根离子反应.
解答 解:A.Ca2+、SO42-之间反应生成硫酸钙沉淀,在溶液中不能大量共存,故A错误;
B.Cu2+、NH4+、NO3-、Cl-之间不反应,且在弱酸性溶液中不发生反应,能够大量共存,故B正确;
C.使石蕊试液变蓝的溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.水电离的c(OH-)=10-10mol/L溶液中存在大量氢离子或氢氧根离子,I-、NO3-在酸性条件下能够发生氧化还原反应,Mg2+与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
16.下列解释事实的化学方程式不正确的是( )
| A. | 金属钠在空气中加热,生成淡黄色固体:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2 | |
| B. | 向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O═Al(OH)3 ↓+3NH4+ | |
| C. | 铁在潮湿的环境中生锈:3Fe+4H2O═Fe3O4+4H2↑ | |
| D. | 二氧化氮溶于水有硝酸生成:3NO2 +H2O═2HNO3+NO |
16. 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )| A. | 金属性,甲>乙>丁 | |
| B. | 原子半径,辛>戊>甲 | |
| C. | 形成的最简单氢化物的稳定性,己>戊 | |
| D. | 丙与庚的元素原子核外电子数相差13 |
13.我国自主研发的生物航空煤油在今年三月首次商业载客飞行成功,该生物航空煤油是以“地沟油”为原料,进行裂化、加氢、去氧处理后得到的.下列说法错误的是( )
| A. | 有机化学中加氢和去氧都属于还原反应 | |
| B. | 裂化是化学变化,裂化产物是饱和烃 | |
| C. | “地沟油”的分子中含有不饱和键,加氢能改善其稳定性 | |
| D. | “地沟油”去氧时,氧主要以H2O和CO2等形式脱去 |
20.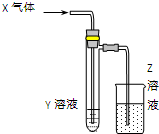 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | Cl2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B、 | C. | C | D. | D |
15.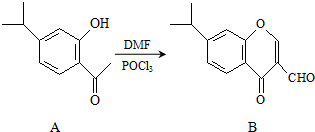 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |

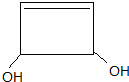 .
.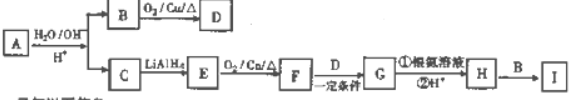
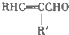 +H2O
+H2O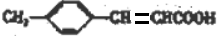 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$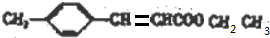 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).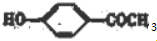 (写结构简式).
(写结构简式).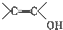 )结构.
)结构.