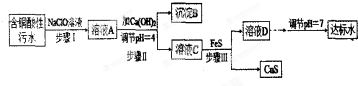
10.欲将某铜矿加工厂产生的含铜酸性污水(如表-1所示)处理成达标水,并回收某些金属化合物,设计如下工艺流程:
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
②国家规定含铜污水排放标准为:pH=7;c(Cu2+)≤1.0×10-7mol•L-1;铁元素含量低于1.0×10-5mol•L-1.
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
请回答:
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).

相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
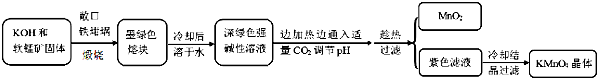
9.高锰酸钾[KMnO4]是常用的氧化剂,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4],如图是实验室模拟制备的操作流程:
相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;

(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
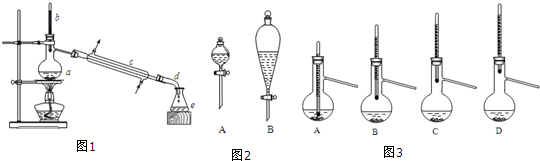
7.实验室利用冰醋酸和正丁醇制备乙酸正丁酯,实验装置如图1所示,可能用到的有关数据如下表:
合成反应:在干燥的a中加入9.32g正丁醇、7.2mL 冰醋酸和3~4滴浓硫酸,摇匀后,加几粒沸石,c中通水,开始缓慢加热,控制馏出物的温度不超过130℃.
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31g.
请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如图2装置中的B(填序号),使用该仪器前应先检漏.
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,图3所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为D(填序号)
(7)本实验所得到的乙酸正丁酯的产率是C(填序号)
A.30% B.40% C.50% D.55%

| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
分离提纯:①将仪器a中反应后的混合液与仪器e中的馏出物合并,转入分液漏斗中;②依次用水、少量的10%碳酸钠溶液和水洗涤,分离后再加干燥剂M,静置一段时间后,弃去M;③将最终得到的反应粗产物转入洗净的仪器a中,加入几粒沸石,进行蒸馏,得到乙酸正丁酯7.31g.
请回答下列问题:
(1)仪器a的名称是蒸馏烧瓶.
(2)在分液时应选如图2装置中的B(填序号),使用该仪器前应先检漏.
(3)写出制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)第一次水洗的目的是除去硫酸及部分乙酸.
(5)干燥剂M可以是B(填序号)
A.五氧化二磷 B.无水硫酸钠 C.碱石灰 D.氢氧化钠固体
(6)步骤③得到的粗产品蒸馏提纯时,图3所示装置中,温度计位置可能导致收集到的产品中混有高沸点杂质的装置为D(填序号)
(7)本实验所得到的乙酸正丁酯的产率是C(填序号)
A.30% B.40% C.50% D.55%
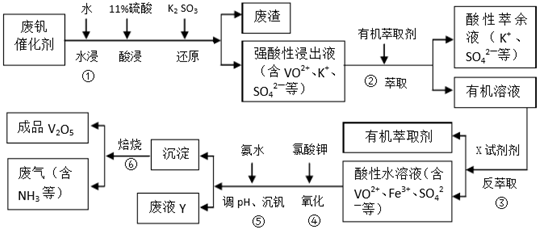
6.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂.为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,则此时溶液中c(Fe3+)=2.6×10-3mol/L.(已知:25℃时k[Fe(OH)3]=2.6×10-39.)

回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
4.下列化学用语正确的是( )
| A. | 醛基的结构简式-COH | B. | 丙烯分子的结构简式为:CH3CHCH2 | ||
| C. | 四氯化碳分子的电子式为: | D. | 2-乙基-1,3-丁二烯的键线式: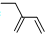 |
1.某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡.为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
(3)对于反应中产生的气体(不考虑水蒸气),请你完成假设二和假设三:假设一:只有CO2;假设二:只有H2;假设三:H2和CO2;
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
0 167806 167814 167820 167824 167830 167832 167836 167842 167844 167850 167856 167860 167862 167866 167872 167874 167880 167884 167886 167890 167892 167896 167898 167900 167901 167902 167904 167905 167906 167908 167910 167914 167916 167920 167922 167926 167932 167934 167940 167944 167946 167950 167956 167962 167964 167970 167974 167976 167982 167986 167992 168000 203614
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 将镁条投入5mL蒸馏水 | 微量气泡 | Mg与蒸馏水缓慢反应 |
| ② | 将镁条投入5mL饱和NaHCO3溶液中 | 镁表面出现大量气泡 | Mg与NaHCO3溶液剧烈反应 |
| ③ | 将镁条投入5mLNaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
| 实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |


 某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸
某课外小组的同学拟用废铝箔制取硫酸铝晶体,已知铝的物种类别与溶液pH关系如图所示,实验中可选用的试剂:处理过的铝箔;2.0mol•L-1NaOH溶液:2.0mol•L-1硫酸