题目内容
1.某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡.为了探究产生此现象的原因,该小组设计实验探究如下:(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 将镁条投入5mL蒸馏水 | 微量气泡 | Mg与蒸馏水缓慢反应 |
| ② | 将镁条投入5mL饱和NaHCO3溶液中 | 镁表面出现大量气泡 | Mg与NaHCO3溶液剧烈反应 |
| ③ | 将镁条投入5mLNaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
| 实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |
分析 (1)配制饱和溶液,只要溶液中有没有溶解的固体NaHCO3,溶液饱和;饱和NaHCO3溶液pH=8.4,是因为HCO3-的水解程度大于其电离程度;
(2)①据实验现象为微量气泡判断实验结论;
②据Mg与NaHCO3溶液剧烈反应判断实验现象;
(3)Mg与NaHCO3溶液反应,可能生成二氧化碳和氢气,据此分析.
解答 解:(1)配制饱和NaHCO3溶液,在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可;饱和NaHCO3溶液pH=8.4,是因为HCO3-的水解大于其电离,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-,
故答案为:在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可;HCO3-+H2O?H2CO3+OH-;
(2)①实验现象为微量气泡,说明Mg与蒸馏水缓慢反应,故答案为:Mg与蒸馏水缓慢反应;
②Mg与NaHCO3溶液剧烈反应,可知镁表面出现大量气泡,故答案为:镁表面出现大量气泡;
(3)Mg与NaHCO3溶液反应,可能生成二氧化碳和氢气,所以假设一:只有CO2时,假设二:只有H2;假设三:两种气体都有,检验二氧化碳气体的存在,可以用湿润的红色石蕊试纸检验,故答案为:H2;H2和CO2;
| 实验步骤 | 想象和结论 |
| 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2 若试纸不变红,气体中无CO2 |
点评 本题考查了饱和溶液的配制、水解离子方程式书写、实验现象的分析判断、气体的检验,题目难度较大.

练习册系列答案
相关题目
7.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
8.液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池.正极采用锂化合物LiCoO2,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(0<x≤1),电解质为溶解有锂盐LiPF6、LiAsF6等的有机溶液.下列有关说法不正确的是( )
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
12.分子式为C10H14的二取代芳烃,其可能的结构有( )
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 10种 |
6.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂.为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
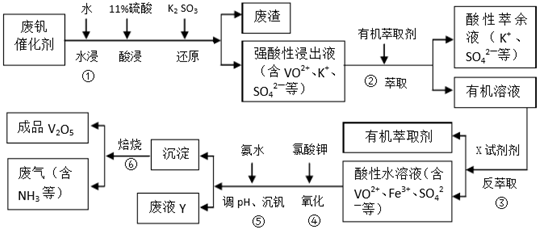
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,则此时溶液中c(Fe3+)=2.6×10-3mol/L.(已知:25℃时k[Fe(OH)3]=2.6×10-39.)

回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
13.为验证氧化性Cl2>Fe3+>SO2,某小组用如图1所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
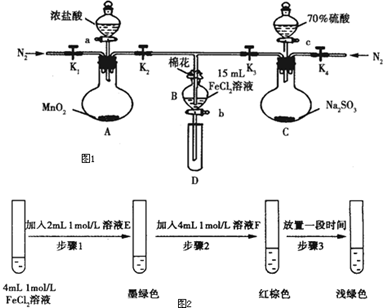
实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色.
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通过一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K2、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
Ⅴ.打开弹簧夹K2,活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K2.
Ⅵ.更换试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰实验.
(2)棉花中浸润的溶液为NaOH溶液.
(3)A中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是70%硫酸中氢离子浓度大于98%的硫酸,因此反应速率更快.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ:B溶液中含有的离子 | 过程Ⅵ:B溶液中含有的离子 | |
| 甲 | 有Fe3+,无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+、又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+、无Fe2+ | 有Fe2+ |
查阅资料:Fe2+(aq)+2SO32-(aq)?FeSO3(s)(墨绿色)
提出假设:FeCl2与SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色.
某同学设计如图2实验,证实该假设成立:
①溶液E和F分别为Na2SO3、FeCl3.
②请用离子方程式解释步骤3中溶液(酸性)由红棕色变浅绿色的原因Fe3+消耗SO32-,c(SO32-)减小,平衡Fe2+(aq)+SO32-(aq)?FeSO3(s)(墨绿色)逆向移动,溶液颜色由红棕色变为浅绿色.
10.已知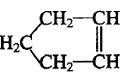 可简写为
可简写为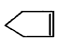 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: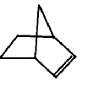
则降冰片烯不具有的性质( )
 可简写为
可简写为 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为:
则降冰片烯不具有的性质( )
| A. | 易溶于水 | B. | 能发生氧化反应 | C. | 能发生加成反应 | D. | 能发生取代反应 |
11.如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
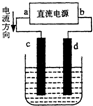

| A. | a为负极、b为正极 | B. | c电极上发生还原反应 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
 .
.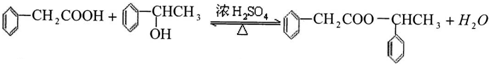 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应). .
.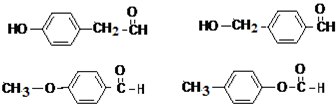 任意一种.
任意一种.