题目内容
9.高锰酸钾[KMnO4]是常用的氧化剂,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4],如图是实验室模拟制备的操作流程: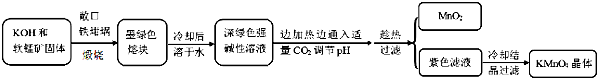
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;

(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
分析 由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)瓷坩埚中的二氧化硅和强碱反应;煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平书写方程式;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3;
(3)醋酸钾的溶解度比高锰酸钾大的多,蒸发浓缩时基本上都会留在母液中,盐酸具有还原性,易被高锰酸钾氧化,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出;
(4)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH;
阳离子交换膜防止锰酸根进入阴极区被还原.
解答 解:由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平后方程式为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,有关反应离子方程式为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O,
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;
(3)盐酸具有还原性,易被高锰酸钾氧化,硫酸加入生成的硫酸钾溶解度小,会随KMnO4一起结晶析出得到的高锰酸钾中含有杂质,醋酸钾的溶解度比高锰酸钾大的多,蒸发浓缩时基本上都会留在母液中,故答案为:a;
(4)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH,电解反应方程式为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH,故A溶液应为KOH溶液;
阳离子交换膜防止锰酸根进入阴极区被还原,提高了Mn元素利用率,
故答案为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查实验制备方案,涉及化学工艺流程、仪器与试剂选择、对实验条件的控制、电解应用、对题目信息获取与应用等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,难度中等.

| A. | 硫的非金属性较强,所以只以化合态存在于自然界 | |
| B. | 分离黑火药(S、C、KNO3)的成分需要使用二硫化碳、水及过滤操作 | |
| C. | 硫与金属或非金属反应时均做氧化剂 | |
| D. | 1.6克硫与6.4克铜反应能得到8.0克纯净硫化物 |
| A. | 用10ml的量筒准确量取8.80ml的稀硫酸 | |
| B. | 用NaOH溶液作标准液滴定未知浓度的醋酸,选择甲基橙做指示剂 | |
| C. | 测定中和反应的热反应,将碱缓慢倒入酸中,所测温度值不变 | |
| D. | 氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| A. | 醛基的结构简式-COH | B. | 丙烯分子的结构简式为:CH3CHCH2 | ||
| C. | 四氯化碳分子的电子式为: | D. | 2-乙基-1,3-丁二烯的键线式: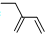 |
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
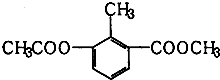
| A. | 一个分子中含有12个H原子 | B. | 该物质属于芳香族化合物 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 苯环上的一氯代物有2种 |
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
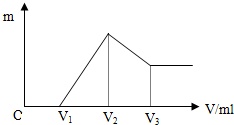 将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.