题目内容
6.五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁.用作合金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂.为了增加V2O5的利用率,我们从废钒催化剂(主要成分V2O5,VOSO4,K2SO4,SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下: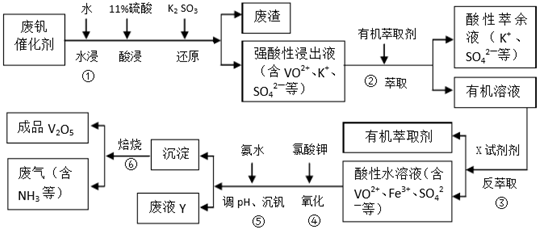
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②,③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+2nHA(有基层)?2RA(有基层)+nH2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;实验室进行萃取操作主要使用的玻璃仪器为分液漏斗和烧杯.
(3)完成④中反应的例子方程式:1ClO3-6VO2++6H+=6VO3+1Cl-+3H2O
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
分析 生产流程:废钒催化剂(主要成分V2O5、Fe2O3和SiO2等),据物质的水溶性确定,V2O5和SiO2难溶于水,即为得到的滤渣亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,过滤得到滤渣为二氧化硅,强酸性浸出液含有VO2+、K+、SO42-,加入有机萃取剂萃取分液得到有机溶液中VO2+,再加入X试剂进行反萃取分液,分离出有机层得到水层是含VO2+、Fe3+、SO42-的酸性水溶液,得到分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;加入硫酸抑制平衡正向进行,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可.
(1)上述分析可知滤渣A为二氧化硅;
(2)反萃取时分析平衡,VOSO4 +(水层)+2HA2(有机层)?VOA2(有机层)+H2SO4(水层),为提高②中萃取百分率,则加入碱中和硫酸使平衡正移、多次连续萃取,萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯;
(3)依据氧化还原反应电子守恒和电荷守恒、原子守恒配平书写离子方程式;
(4)从沉淀率和pH关系找出最佳沉淀率,若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,此时溶液PH=2,计算氢氧根离子浓度,结合溶度积常数计算溶液中铁离子的浓度.
解答 解:生产流程:废钒催化剂(主要成分V2O5、Fe2O3和SiO2等),据物质的水溶性确定,V2O5和SiO2难溶于水,即为得到的滤渣亚硫酸根具有还原性,酸性条件下,能被五氧化二钒氧化生成硫酸根离子,离子反应方程式为:V2O5+SO32-+4H+=2VO2++SO42-+2H2O,过滤得到滤渣为二氧化硅,强酸性浸出液含有VO2+、K+、SO42-,加入有机萃取剂萃取分液得到有机溶液中VO2+,再加入X试剂进行反萃取分液,分离出有机层得到水层是含VO2+、Fe3+、SO42-的酸性水溶液,得到分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;加入硫酸抑制平衡正向进行,氯酸钾具有氧化性,能将VO2+氧化为VO2+,加入氨水,调节溶液pH到最佳值,得到NH4VO3,最后焙烧得到五氧化二钒即可;
(1)上述分析可知①中废渣的主要成分是二氧化硅,故答案为:SiO2;
(2)反萃取时分析平衡,VOSO4 +(水层)+2HA2(有机层)?VOA2(有机层)+H2SO4(水层),为提高②中萃取百分率,则加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率,萃取分液操作时,用到的玻璃仪器有分液漏斗和烧杯,
故答案为:加入碱中和硫酸使平衡正移、多次连续萃取,提高钒的萃取率;分液漏斗和烧杯;
(3)ClO3-中氯元素化合价+5价变化为-1价,VO2+变化为VO3+,V元素化合价+4价变化为+5价,电子守恒VO2+和VO3+ 的系数为6,ClO3-中和Cl-前系数为1,结合电荷守恒和原子守恒配平书写离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1;6;6H+;6;1;3H2O;
(4)从沉淀率和pH关系可知,随pH增大,沉淀率先增大后减小,故沉淀率最大的pH即为最佳pH,pH=1.7时钒的沉淀率最大为98.8%,加入氨水调节溶液的最佳pH为为1.7,若钒沉淀率为93.1%时不产生Fe(OH)3,沉淀,此时溶液PH=2,计算氢氧根离子浓度c(OH-)=10-12mol/L,k[Fe(OH)3]=2.6×10-39=c(Fe3+)c3(OH-),c(Fe3+)=$\frac{2.6×1{0}^{-39}}{(1{0}^{-12})^{3}}$=2.6×10-3mol/L,故答案为:1.7;2.6×10-3mol/L.
点评 本题考查了流程分析判断,物质性质和实验设计的方法应用,氧化还原反应配平,溶度积计算,题干信息分析判断能力,掌握基础是关键,题目难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 浓硫酸能使蔗糖变黑,体现浓硫酸具有强酸化性 | |
| B. | 铵盐受热易分解,均有NH3产生 | |
| C. | 闪电时,N2转化为NO可以称为氮的固定 | |
| D. | 化工厂可通过加高烟囱排放废气,防止形成酸雨 |
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| ① | 将镁条投入5mL蒸馏水 | 微量气泡 | Mg与蒸馏水缓慢反应 |
| ② | 将镁条投入5mL饱和NaHCO3溶液中 | 镁表面出现大量气泡 | Mg与NaHCO3溶液剧烈反应 |
| ③ | 将镁条投入5mLNaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
请假设实验,用镁条和饱和NaHCO3溶液制取气体并检验其中是否含有CO2,写出实验步骤和结论.
| 实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 |
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物.
| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑥ |
| A. | 铁锈可用稀盐酸洗去 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 在Fe与稀H2SO4反应时,加几滴CuSO4溶液,可加快反应速率 | |
| D. | 红热的铁丝与水接触表面形成蓝黑色保护层 |
| A. | 34S原子核内中子数为16 | B. | 1H218O的摩尔质量为20g/mol | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H+的核外电子数为2 |