题目内容
10.欲将某铜矿加工厂产生的含铜酸性污水(如表-1所示)处理成达标水,并回收某些金属化合物,设计如下工艺流程: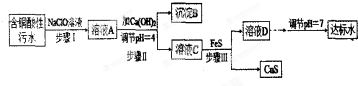
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
| l离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol•L-1) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp)(见表-2)
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Ksp | 4.0×10-22 | 8.0×10-16 | 2.2×10-20 | 6.4×10-12 | 6.0×10-26 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤Ⅱ中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤Ⅲ中发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂的,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
分析 含铜酸性污水加入次氯酸钠,次氯酸根离子具有氧化性,氧化污水中具有还原性的亚铁离子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液A主要含有铁离子、铜离子、氯离子等,步骤Ⅱ加入氢氧化钙,调节PH=4,生成氢氧化铁沉淀,沉淀B为Fe(OH)3,溶液C中主要含有铜离子、氯离子等,步骤Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,亚铁离子转化成氢氧化铁进行回收,溶液D调节PH=7,处理成达标水.
(1)根据含铜酸性污水c(H+)=0.1mol/L,pH=-lg[c(H+)]分析;
(2)含铜酸性污水加入次氯酸钠,次氯酸根离子具有氧化性,氧化污水中具有还原性的亚铁离子,两者发生氧化还原反应;
(3)步骤Ⅱ加入氢氧化钙,调节PH=4,使Fe(OH)3沉淀完全,防止步骤Ⅲ中加入FeS过量溶解;
(4)步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,c(OH-)=10-7mol/L,根据Cu(OH)2存在如下平衡:Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),计算c(Cu2+);
(5)步骤Ⅲ中加入FeS,硫化亚铁和铜离子发生复分解反应,该过程不选用易溶的Na2S,Na2S价格高且引入过多杂质离子;
(6)沉淀B为Fe(OH)3,步骤Ⅲ中加入FeS,得到CuS,亚铁离子转化成氢氧化铁进行回收;
解答 解:含铜酸性污水加入次氯酸钠,次氯酸根离子具有氧化性,氧化污水中具有还原性的亚铁离子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,溶液A主要含有铁离子、铜离子、氯离子等,步骤Ⅱ加入氢氧化钙,调节PH=4,生成氢氧化铁沉淀,沉淀B为Fe(OH)3,溶液C中主要含有铜离子、氯离子等,步骤Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,溶液D调节PH=7,处理成达标水.
(1)含铜酸性污水c(H+)=0.1mol/L,pH=-lg[c(H+)]=-lg[0.1]=1,
故答案为:1;
(2)含铜酸性污水加入次氯酸钠,次氯酸根离子具有氧化性,氧化污水中具有还原性的亚铁离子2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)Fe(OH)3存在如下平衡:Fe(OH)3(s)?Fe3+(aq)+3OH-(aq),Fe(OH)3饱和溶液中c(Fe3+)=0.04mol•L-1,Fe(OH)3?Fe3++3OH-生成的氢氧根c(OH-)=0.12mol/L,c(H+)=$\frac{1{0}^{-14}}{0.12}$mol/L≈8.3×10-12mol/L,PH=12-lg8.3,步骤Ⅱ加入氢氧化钙,调节PH=4,使Fe(OH)3沉淀完全,FeS能溶于pH<4的酸性溶液,防止步骤Ⅲ中加入FeS过量溶解,
故答案为:使沉淀完全,防止沉淀,防止FeS溶解;
(4)步骤Ⅱ中只需加入Ca(OH)2调节溶液的pH=7,c(OH-)=10-7mol/L,Cu(OH)2(s)?Cu2+(aq)+2OH-(aq),氢氧化铜沉淀,溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1,所以不合理,
故答案为:不合理;pH=7时溶液中c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1×1{0}^{-7})^{2}}$=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1;
(5)步骤Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,该过程不选用易溶的Na2S,Na2S价格高且引入过多杂质离子钠离子和硫离子,
故答案为:Cu2++FeS=CuS+Fe2+;Na2S价格高且引入过多杂质离子;
(6)调节PH=4,沉淀B为Fe(OH)3,步骤Ⅲ中加入FeS,FeS能溶于pH<4的酸性溶液,Cu2++FeS=CuS+Fe2+,得到CuS,亚铁离子转化成氢氧化铁进行回收,上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS,
故答案为:Fe(OH)3、CuS.
点评 本题考查了工艺流程图的分析判断,解答本题要充分理解各种物质的性质,从而得出正确的结论,应熟悉混合物的分离方法,掌握沉淀与PH关系是解答关键,题目难度中等.

| A. | 自然界含硫化合物的分解和氧化 | B. | 火山喷发 | ||
| C. | 工厂排出的废气 | D. | 大量燃烧含硫燃料 |
| A. | R的最高价氧化物对应的水化物的酸性比X的弱 | |
| B. | 非金属性:Y>X | |
| C. | 原子半径的大小顺序:X>Z | |
| D. | Z元素最高价氧化物对应的水化物具有两性 |
CH3COOH溶液,得到2条滴定曲线,如图所示:以下说法正确的是( )
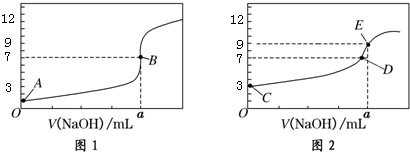
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
| A. | 离子化合物中不一定含有金属元素 | |
| B. | 由不同原子所形成的纯净物不一定是化合物 | |
| C. | 分子中一定含有化学键 | |
| D. | 含有金属元素的离子不一定是阳离子 |

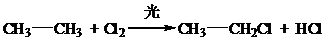 、取代反应
、取代反应 、取代反应.
、取代反应. D
D