��Ŀ����
5��ij��ȤС���ѧ�����ݻ��ý���Mg��CO2������Ӧ���Ʋ���ý�����Ҳ����CO2������Ӧ�����ʵ��С��������װ�ý��С����������̼��Ӧ����ʵ��̽����β������װ������ȥ������֪�������£�CO��ʹһЩ�������еĽ������ӻ�ԭ��
���磺PdCl2+CO+H2O=Pd��+CO2+2HCl��Ӧ���ɺ�ɫ�Ľ����٣��˷�ӦҲ�����������CO�Ĵ��ڣ�
��ش��������⣺
��1��Ϊ��ʹ����װ���ܡ��濪���ã������ͣ������ͼ2A����ȡCO2����Ӧѡ�õ�װ���Ǣ���д��I���������������ӷ���ʽ��CaCO3+2H+=Ca2++H2O+CO2����װ��B��C��Ӧʢ�ŵ��Լ��ֱ��DZ���NaHCO3��Ũ���ᣮ
��2���۲�ʵ��װ��ͼ��֪Na��CO2��Ӧ�������Ǹ��£���ǿ�ȣ������װ�õ���������ò�װ��ҩƷ���ڵ�ȼ�ƾ����ǰ��������еIJ����Ǵ��е�ֹˮ�У��ⲽ������Ŀ�����ų�װ���еĿ�����
��3������CO2����Ϊ��������ʵ������зֱ�������¢١������ֲ�ͬ�������������ش����⣺
����װ��F����Һ�����Ա仯��װ��D���������ֹ������ʣ�ȡ�������������������ᷴӦ������ʹ����ʯ��ˮ����ǵ�����ų��������������̼��Ӧ�Ļ�ѧ����ʽ��4Na+3CO2$\frac{\underline{\;����\;}}{\;}$2Na2CO3+C��
����װ��F���к�ɫ�������ɣ�װ��D��ֻ����һ�ֹ������ʣ�ȡ�����ù��������ᷴӦ��Ҳ����ʹ����ʯ��ˮ����ǵ�����ų��������������̼��Ӧ�Ļ�ѧ����ʽ��2Na+2CO2$\frac{\underline{\;����\;}}{\;}$Na2CO3+CO��
��4�����жϢ���Dװ�����ɹ���ijɷ����Ƶ����Σ�����Ρ�����ʽ�Ρ������������ּ�Ҫ˵�����ɸ��������غ㶨�ɿ�֪����Ӧ�ﹲ������Ԫ�أ�û����Ԫ�أ���˲���������ʽ�Σ�������������Ϊ����������̼�����Ʋ����ڣ���
���� ��װ����AĿ������ȡCO2���壬ʵ������ϡ�����CaCO3��Ӧ��ȡCO2��������лӷ��ԣ�������ȡ��CO2�к���HCl��Ϊ��ֹ����ʵ�飻��Bװ������HCl������Ӱ��CO2��B��ʢ�ŵ������DZ���NaHCO3��Һ��B����Һ����ˮ�֣��ܺ�Na��Ӧ��Ϊ��ֹ����ʵ�飬C����Ũ�������CO2��D��Na��CO2������Ӧ��E��������CO2��F����CO��
��1��Ϊ��ʹ����װ���ܡ��濪���ã������ͣ������װ��Ӧ�ú����շ��������ƣ�CaCO3��ϡ���ᷴӦ�����Ȼ��ơ�������̼��ˮ��ʵ�����ñ���̼����������HCl����Ũ������������̼��
��2����ȼ�ƾ���Ƶõ����¶Ƚϸߣ������������ܺ�Na�ڵ�ȼ���������ɹ������ƣ�
��3���ٸ���Ԫ���غ�֪���ܺ�ϡ���ᷴӦ������ʹ����ʯ��ˮ����ǵ������Ƕ�����̼����õ�������һ�ֹ�����̼���ƣ�����Ԫ�ػ��ϼ۱仯֪�����ɵ���һ�ֹ�����C��
�ڸ���Ԫ���غ�֪���ܺ�ϡ���ᷴӦ������ʹ����ʯ��ˮ����ǵ������Ƕ�����̼����õ�������һ�ֹ�����̼���ƣ�F�����ɺ�ɫ���壬D������CO��
��4���κλ�ѧ��Ӧ����ѭ�����غ㶨�ɣ����������غ㶨��ȷ������ɷ֣�
��� �⣺��װ����AĿ������ȡCO2���壬ʵ������ϡ�����CaCO3��Ӧ��ȡCO2��������лӷ��ԣ�������ȡ��CO2�к���HCl��Ϊ��ֹ����ʵ�飻��Bװ������HCl������Ӱ��CO2��B��ʢ�ŵ������DZ���NaHCO3��Һ��B����Һ����ˮ�֣��ܺ�Na��Ӧ��Ϊ��ֹ����ʵ�飬C����Ũ�������CO2��D��Na��CO2������Ӧ��E��������CO2��F����CO��
��1��Ϊ��ʹ����װ���ܡ��濪���ã������ͣ������װ��Ӧ�ú����շ��������ƣ�ֻ�Т���ϣ�CaCO3��ϡ���ᷴӦ�����Ȼ��ơ�������̼��ˮ�����ӷ���ʽΪCaCO3+2H+=Ca2++H2O+CO2����ʵ������ϡ�����CaCO3��Ӧ��ȡCO2��������лӷ��ԣ�������ȡ��CO2�к���HCl��Ϊ��ֹ����ʵ�飻��Bװ������HCl������Ӱ��CO2��B��ʢ�ŵ������DZ���NaHCO3��Һ��B����Һ����ˮ�֣��ܺ�Na��Ӧ��Ϊ��ֹ����ʵ�飬C����Ũ�������CO2��
�ʴ�Ϊ����CaCO3+2H+=Ca2++H2O+CO2��������NaHCO3��ŨH2SO4��
��2����ȼ�ƾ���Ƶõ����¶Ƚϸߣ������䷴Ӧ����Ϊ���£���ǿ�ȣ��������������ܺ�Na�ڵ�ȼ���������ɹ������ƣ�����ʵ�飬�ö�����̼�������ų�����ֹ����ʵ�飬����Ӧ�ô��е�ֹˮ�У�
�ʴ�Ϊ�����£�ǿ�ȣ������е�ֹˮ�У��ų���װ���еĿ�����
��3���ٸ���Ԫ���غ�֪���ܺ�ϡ���ᷴӦ������ʹ����ʯ��ˮ����ǵ������Ƕ�����̼����õ�������һ�ֹ�����̼���ƣ�����Ԫ�ػ��ϼ۱仯֪�����ɵ���һ�ֹ�����C�����ݷ�Ӧ������P��Ӧ�����÷���ʽΪ4Na+3CO2 $\frac{\underline{\;����\;}}{\;}$ 2Na2CO3+C���ʴ�Ϊ��4Na+3CO2 $\frac{\underline{\;����\;}}{\;}$ 2Na2CO3+C��
�ڸ���Ԫ���غ�֪���ܺ�ϡ���ᷴӦ������ʹ����ʯ��ˮ����ǵ������Ƕ�����̼����õ�������һ�ֹ�����̼���ƣ�F�����ɺ�ɫ���壬D������CO�����ݷ�Ӧ������P��Ӧ�����÷���ʽΪ2Na+2CO2$\frac{\underline{\;����\;}}{\;}$ Na2CO3+CO���ʴ�Ϊ��2Na+2CO2$\frac{\underline{\;����\;}}{\;}$ Na2CO3+CO��
��4���κλ�ѧ��Ӧ����ѭ�����غ㶨�ɣ����������غ㶨��֪���������к���C��O��NaԪ�أ�����HԪ�أ�����������ֻ�������β�������ʽ�Σ�
�ʴ�Ϊ�����Σ����������غ㶨�ɿ�֪����Ӧ�ﹲ������Ԫ�أ�û����Ԫ�أ���˲���������ʽ�Σ�������������Ϊ����������̼�����Ʋ����ڣ���
���� ���⿼������ʵ�鷽����ƣ�Ϊ��Ƶ���㣬��ȷʵ��ԭ���ǽⱾ��ؼ���֪��װ����ÿ��װ�õ����ü�ʵ��Ŀ�ģ�ͬʱ����ѧ��ʵ�����������˼ά�������ԣ��ѵ��ǣ�3���⣮

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�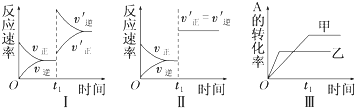
| A�� | ͼ���ʾ����t1ʱ������Ӧ���Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� | |
| B�� | ͼ���ʾ��һ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ�� | |
| C�� | ͼ���ʾ�����¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϸ� | |
| D�� | ͼ���ʾ���Dz�ͬ������ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ� |
| A�� | �ճ���������ˮ�Ҵ�������ɱ������ | |
| B�� | �ޡ��顢˿��ë���ϳ���ά��ȫȼ�ն�ֻ����CO2��H2O | |
| C�� | ������ɱ�����в���ʽ��Ϊ�����ĵ��������ȱ��� | |
| D�� | ������ά���ϳ���ά���ά�����л��߷��ӻ����� |
| A�� | �����£�0.1 mol•L-1Na2S��Һ�д��ڣ�c��OH-��=c��H+��+c��HS-��+c��H2S�� | |
| B�� | �����£�0.1 mol•L-1HA��Һ��0.1 mol•L-1 NaOH��Һ������ȫ��Ӧʱ����Һ��һ�����ڣ�c��Na+��=c��A-����c��OH-��=c��H+�� | |
| C�� | �����£�pH=7��CH3COONa��CH3COOH�����Һ��c��Na+��=0.1 mol•L-1��c��Na+��=c��CH3COOH����c��CH3COO-����c��H+��=c��OH-�� | |
| D�� | �����£���0.1 mol•L-1CH3COOH ��Һ��ˮϡ�ͣ�����Һ��pH��3.0����4.0ʱ����Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��}$��ֵ����ԭ����10�� |
�����Ϣ��
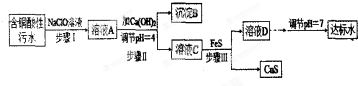
�ٺ�ͭ������ˮ��Ҫ��Ⱦ�����ӣ�����-1��
| l���� | H+ | Cu2+ | Fe3+ | Fe2+ |
| Ũ��/��mol•L-1�� | 0.1 | 0.05 | 0.04 | 0.002 |
��FeS������pH��4��������Һ��
��25��ʱ��ijЩ���ܵ���ʵ��ܶȻ���Ksp��������-2��
| ���� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | FeS | CuS |
| Ksp | 4.0��10-22 | 8.0��10-16 | 2.2��10-20 | 6.4��10-12 | 6.0��10-26 |
��1���ú�ͭ������ˮ��pH=1��
��2�������������������Ҫ��Ӧ�����ӷ���ʽΪ2Fe2++ClO-+2H+=2Fe3++Cl-+H2O��
��3��������У�������Һ��pH=4��Ŀ��Ϊʹ������ȫ����ֹ��������ֹFeS�ܽ⣮
��4��������Ϊ���������ֻ�����Ca��OH��2������Һ��pH=7�����ɽ���ˮ�����ɷ��ϱ��Ĵ��ˮ���ù۵㲻���������������������������ͨ������˵������pH=7ʱ��Һ��c��Cu2+��=$\frac{2.2��1{0}^{-20}}{��1��1{0}^{-7}��^{2}}$=2.2��10-6mol•L-1�����ڹ��ҹ涨���ŷű�c��Cu2+����1.0��10-7mol•L-1��
��5��������з�������Ҫ��Ӧ�����ӷ���ʽΪCu2++FeS=CuS+Fe2+���ù��̲�ѡ�����ܵ�Na2S���������ģ���ԭ�����ΪNa2S�۸������������������ӣ�
��6�������������������У����Ի��յĽ�����������Fe��OH��3��CuS���ѧʽ����
| A�� | 14Cԭ����C60����̼ͨԭ�ӵĻ�ѧ������ͬ | |
| B�� | 14Cԭ����14Nԭ��������������ͬ | |
| C�� | 14C��C60��ͬ�������� | |
| D�� | 14CO��12CO��13CO��̼Ԫ�ص�����ͬλ�� |
| A�� | �����ѹǿ���� | B�� | ����ƽ����Է����������� | ||
| C�� | ������ܶȲ��� | D�� | B���ʵ���Ũ�Ȳ��� |
| A�� | ȼ��һ��Ҫ�������μ� | B�� | �з�������ı仯һ����ȼ�� | ||
| C�� | ȼ��һ���з��ⷢ������ | D�� | ȼ�յ�������һ�������� |