17.下列说法正确的是( )
| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
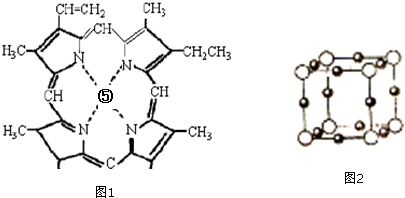
16.已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素.A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2.
(1)E3+的核外有5个未成对电子,A2C2的电子式为 .
.
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子之间有氢键,而H2S分子间不存在氢键,所以H2O2的熔沸点比H2S高,H2O2与水分子之间能形成氢键,所以H2O2易溶于水,而H2S不能,所以H2O2在水中的溶解性比H2S好.
(1)E3+的核外有5个未成对电子,A2C2的电子式为
 .
.(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
15. X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
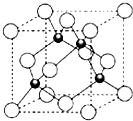
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
13.元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z基态原子的2p轨道上有3个未成对电子.下列说法正确的是( )
| A. | X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有12mol σ键 | |
| B. | Z的最高价含氧酸分子中,羟基氧和非羟基氧个数比为1:1 | |
| C. | Y的气态氢化物分子中H-Y-H键角比Y的最高价氧化物分子中O-Y-O键角小 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定,是因为氢键的影响 |
12.有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个.下列说法正确的是( )
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
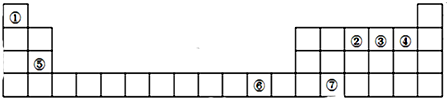
11.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )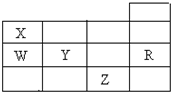

| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |
10.下列说法中正确的是( )
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
9.下列物质分子中,既含有极性键又含有非极性键的非极性分子是( )
| A. | C2H4 | B. | Br2 | C. | Na2O2 | D. | CH3COOH |
8.下列物质中同时具有离子键、共价键和配位键的是( )
0 167761 167769 167775 167779 167785 167787 167791 167797 167799 167805 167811 167815 167817 167821 167827 167829 167835 167839 167841 167845 167847 167851 167853 167855 167856 167857 167859 167860 167861 167863 167865 167869 167871 167875 167877 167881 167887 167889 167895 167899 167901 167905 167911 167917 167919 167925 167929 167931 167937 167941 167947 167955 203614
| A. | H3O+ | B. | NaOH | C. | NH4Cl | D. | H2SO4 |