题目内容
17.下列说法正确的是( )| A. | CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构 | |
| B. | 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低 | |
| C. | 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低 | |
| D. | 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2 |
分析 A、CH4分子中氢最外层只有2个电子;
B、根据离子半径对金属性的影响分析解答碱金属元素单质熔点变化;
C、第ⅦA族元素形成的单质的熔点随原子序数的递增而升高;
D、水中O元素化合价为-2价.
解答 解:A、CH4分子中氢最外层只有2个电子,而不是8电子结构,故A错误;
B、碱金属都为固体,碱金属自上而下,离子半径增大,金属键减弱,熔点降低,故B正确;
C、分子晶体的熔沸点随着相对分子质量的增大而升高,第ⅦA族元素形成的单质为分子晶体,则其单质的熔点随原子序数的递增而升高,故C错误;
D.H2O、Li2O中O元素化合价为-2价,故D错误.
故选B.
点评 本题考查较综合,涉及物质的结构、物质的性质等知识点,根据物质的构成、物质的熔沸点与相对分子质量的关系等知识点来分析解答,比较容易.

练习册系列答案
相关题目
7.下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
| A. |
| B. |
| C. |
| D. |
|
8.变黑的银器可根据电化学原理进行翻新,其方法如下:在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后黑色会褪去,该反应的化学方程式为:2Al+3Ag2S+6H2O=6Ag+3H2S↑+2Al(OH)3.下列关于说法正确的是( )
| A. | 正极反应式:Al-3e-+3H2O=Al(OH)3+3H+ | |
| B. | 放电过程中,Cl-向正极移动 | |
| C. | 每转移0.2mol电子,理论上生成0.1molH2S气体 | |
| D. | 处理过程中银器一直保持恒重 |
12.有A、B、C、D、E五种短周期元素,A原子核外电子占据5条轨道,有两个未成对电子,B元素有3种同位素B1、B2、B3,B3原子的质量数是B1的3倍,C原子核外有9种不同运动状态的电子,D和C可以形成DC型离子化合物,且离子的电子层结构相同,E元素原子的最外层电子数比内层电子总数少6个.下列说法正确的是( )
| A. | 离子半径:D+>C- | |
| B. | EA2是原子晶体 | |
| C. | A和B形成的原子个数比为1:1的化合物分子是非极性分子 | |
| D. | 以上元素中形成的最高价氧化物对应的水化物酸性最强的是C |
2.下列实验中,反应速率加快属于由催化剂引起的是( )
| A. | 氯化钠与浓硫酸混合加热后,撒入二氧化锰即放出氯气 | |
| B. | 过氧化氢中加入几滴氯化铁溶液,可较快放出气体 | |
| C. | 在木炭粉中加入微量氯酸钾,燃烧时极为剧烈 | |
| D. | 用锌与稀硫酸反应制备氢气时,加入少量硫酸铜加快反应 |
9.为说明氯比硫的非金属性强,下列事实可作依据的是( )
| A. | HCl的溶解性强于H2S | B. | 氯的最高价为+7价 | ||
| C. | HCl的稳定性强于H2S | D. | HClO的氧化性强于H2SO4 |
6.在100mL1mol•L-1 AlCl3溶液中滴加1mol•L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是( )
| A. | 160mL | B. | 200mL | C. | 300mL | D. | 350mL |
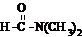 溶于水
溶于水 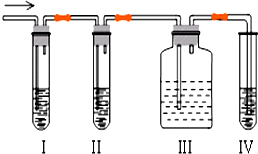 石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题:
石油裂解产品乙烯是一种重要的化工原料,我们已学过用两种方法制得乙烯:在实验室里用乙醇与浓硫酸共热制乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2,回答下列问题: