题目内容
15. X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1.(1)X元素组成的单质的晶体堆积模型为b(填代号).
a.简单立方堆积
b.体心立方堆积
c.六方最密堆积
d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为+6;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是非极性(填“极性”或“非极性”)分子.
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因是Cu+和Cl-间通过配位键形成的配离子易溶于水.
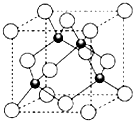
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol(列式表示).
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2-比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
| r(Zn2+) | r(Z+) | r(S2-) | r(Cl-) | 熔点 | |
| ZnS | ZCl | ||||
| 74pm | 77pm | 184pm | 181pm | 1700℃ | 430℃ |
分析 X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1,X是K元素、Y是Cr元素、Z是Cu元素,
(1)X是K元素,其单质属于体心立方最密堆积;
(2)Y是Cr元素,其价电子数是6,所以其最高正化合价为+6价;根据相似相溶原理判断该分子类型;
(3)Cu+和Cl-间易形成配离子,该配离子易溶于水;
(4)该晶胞中Cu离子个数=4、Cl离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞边长=apm=a×10-10 cm,晶胞体积=(a×10-10cm)3,阿伏伽德罗常数=$\frac{4M}{ρV}$;
(5)ZnS和CuCl结构相似,这两种物质都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比.
解答 解:X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1,X是K元素、Y是Cr元素、Z是Cu元素,
(1)X是K元素,其单质属于体心立方最密堆积,故选b;
(2)Y是Cr元素,其价电子数是6,其价电子易失电子,所以其最高正化合价为+6价;根据相似相溶原理知,非极性分子的溶质极易溶于非极性分子的溶剂,YO2Cl2能与CCl4、CS2等互溶,CCl4、CS2都是非极性分子,所以YO2Cl2为非极性分子,故答案为:+6;非极性;
(3)亚铜离子中含有空轨道、氯离子中含有孤电子对,所以Cu+和Cl-间易形成配离子,该配离子易溶于水,所以CuCl微溶于水,但能溶解在氯化钾的浓溶液中,
故答案为:Cu+和Cl-间通过配位键形成的配离子易溶于水;
(4)该晶胞中Cu离子个数=4、Cl离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞边长=apm=a×10-10 cm,晶胞体积=(a×10-10cm)3,阿伏伽德罗常数=$\frac{4M}{ρV}$=$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol,
故答案为:$\frac{4×99.5}{ρ(a×1{0}^{-10})^{3}}$/mol;
(5)ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2- 比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高,
故答案为:ZnS和CuCl结构相似,Zn2+和Cu+、S2-和Cl-的半径相差不大,Zn2+、S2- 比Cu+、Cl-带的电荷数多,所以ZnS的晶格能比CuCl大,ZnS的熔点比CuCl高.
点评 本题考查物质结构和性质,涉及晶胞计算、离子晶体熔沸点影响因素、相似相溶原理等知识点,这些都是高频考点,难点是晶胞计算,注意晶格能大小影响因素,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | c(H+)=c(OH-)的溶液中:SO42-、Na+、Cl-、Fe3+ | |
| B. | 在c(HCO3-)=0.1mol•L-1的溶液中:[Al(OH)4]-、Na+、NO3-、C6H5O- | |
| C. | 饱和氯水中:K+、Mg2+、CH3COO-、SO42- | |
| D. | 能使酚酞变红的溶液:Ba2+、NO3-、I-、Na+ |
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | 甲胺(分子式CH3NH2)的沸点比三甲胺(分子式(CH3)3N)的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 |
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |
| A. | FeSO4溶液中含少量CuSO4杂质:加入过量的Fe粉,过滤 | |
| B. | 碳酸钠粉末中含有少量碳酸氢钠粉末:加热 | |
| C. | 除去FeCl3溶液中的FeCl2:加入氯水 | |
| D. | CO2中混有HCl气体:通入饱和的碳酸钠溶液 |
| A. | 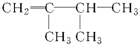 | B. | 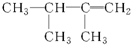 | C. |  | D. | 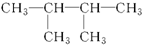 |
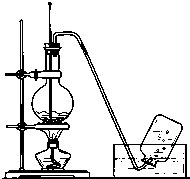 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时: ;
;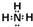 ;
;