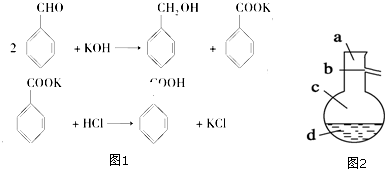
题目内容
11.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
| A. | 常压下Z的单质沸点最高 | B. | 电负性W小于Y | ||
| C. | W的氢化物比X的氢化物稳定 | D. | R的单质在固态时属于原子晶体 |
分析 由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.根据单质的状态进行判断;
B.同周期自左而右电负性增大;
C.非金属性越强,氢化物越稳定;
D.稀有气体在固态为分子晶体.
解答 解:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.常温下氮气、氩为气体,磷、硫为固体,而溴为液,故溴的沸点不是最高的,故A错误;
B.同周期自左而右电负性增大,故电负性W小于Y,故B正确;
C.非金属性X>W,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故C错误;
D.稀有气体Ar在固态为分子晶体,故D错误,
故选B.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列各物质中,互为同系物的是( )
| A. | 丁烷和2,2-二甲基丙烷 | B. |  和 和 | ||
| C. | CH2=CH-CH=CH2和CH3-CH2-C≡CH | D. |  和 和 |
16.已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素.A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2.
(1)E3+的核外有5个未成对电子,A2C2的电子式为 .
.
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因H2O2分子之间有氢键,而H2S分子间不存在氢键,所以H2O2的熔沸点比H2S高,H2O2与水分子之间能形成氢键,所以H2O2易溶于水,而H2S不能,所以H2O2在水中的溶解性比H2S好.
(1)E3+的核外有5个未成对电子,A2C2的电子式为
 .
.(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=4.
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有ABFG.(填代号)
A.非极性键 B.极性键 C. s-sσ键 D.s-pσ键
E.p-pπ键 F.s-sp3σ键 G.sp3-sp3σ键H.sp3-sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| A2D | 187 | 202 | 2.6 |
| A2C2 | 272 | 423 | 以任意比互溶 |
3.有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;
③A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,外电路电流由D到C;
③A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应.
据此,判断四种金属的活动性顺序是( )
| A. | A>C>D>B | B. | A>B>C>D | C. | C>A>D>B | D. | C>B>D>A |
20.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同,将 1.0L这种混合气体在氧气中充分燃烧,生成2.0LCO2和2.4L水蒸气(相同条件下测定).则混合物中烷烃和烯烃的体积比为( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 3:2 |
1.下列各项不属于官能团的是( )
| A. | NO${\;}_{3}^{-}$ | B. | -Cl | C. |  | D. | -NO2 |