题目内容
9.下列物质分子中,既含有极性键又含有非极性键的非极性分子是( )| A. | C2H4 | B. | Br2 | C. | Na2O2 | D. | CH3COOH |
分析 非极性共价键为同种非金属元素的原子间形成共价键;极性共价键是由不同种非金属元素的原子间易形成的共价键;由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,以此解答该题.
解答 解:A.含有C-H极性键,C=C非极性键,结构对称,为非极性分子,故A正确;
B.为单质,不含极性键,故B错误;
C.为离子化合物,极性、非极性只针对共价化合物,故C错误;
D.结构不对称,为极性分子,故D错误.
故选A.
点评 本题考查化学键的极性、分子极性,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
19.某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质.为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去).下列说法的是( )


| A. | 起始滤液常温下pH=7 | B. | 试剂Ⅰ为 Ba(NO3)2溶液 | ||
| C. | 上图过程须经2次过滤 | D. | 步骤③目的是除去 CO32- |
17.将一定量的Cl2通入30mL10.00 mol•L-1的浓KOH溶液中,适当加热使溶液中形成KCl、KClO、KClO3共存体系,下列有关说法错误的是 ( )
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
1.下列各组物质的性质及粒子的性质变化正确的是( )
| A. | 稳定性H2S>HCl>HBr>HI | B. | 酸性HF>HCl>HBr>HI | ||
| C. | 离子半径K+>Cl->S2->S | D. | 酸性HClO4>H2SO4>H2CO3>HClO |
18.等质量的铜片在酒精灯上加热后,分别插入下列液体中,放置片刻后取出,铜片质量增加的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 稀硝酸 | D. | NaOH溶液 |


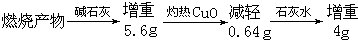

 (1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断:
(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为PbO2+Pb+2H2SO4═2PbSO4+2H2O,据此判断: