18.下列关于价电子构型3s23p4的描述不正确的是( )
| A. | 它的元素符号为S | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成气态化合物 | |
| D. | 其轨道表示式为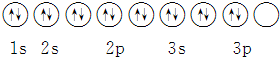 |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 范德华力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 范德华力 | D. | 范德华力 氢键 非极性键 |
16.下列叙述中,错误的是( )
| A. | 离子化合物中可能含有非极性键 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 原子晶体中可能含有非极性键 | |
| D. | 氯化钠晶体熔化时离子键发生断裂 |
15.下列判断正确的是( )
| A. | Na2S2O3溶液中加入稀硫酸的离子方程式为:2S2+4H+═SO42-+3S↓+2H2O | |
| B. | 用TiCl4制备TiO2的反应可表示为:TiCl4+(x+2)H2O(过量)═TiO2•xH2O↓+4HCl | |
| C. | 滴加甲基橙试液后呈红色的溶液中可以大量共存:Na+、CO32-、K+、Al3+ | |
| D. | 25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA |
14.常温下(I)100mL0.1mol/L的NaA溶液中的离子总物质的量为X,(Ⅱ)100mL 0.1mol/L的NaB溶液中的离子总物质的量为Y.下列推断正确的是( )
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
12.利用海水制备部分物质的流程图如下.下列有关说法正确的是( )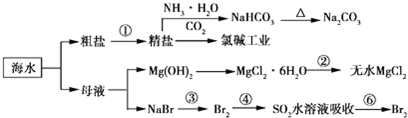

| A. | 电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用 | |
| B. | 联合制碱法最终副产物为氯化铵,原子利用率小于100% | |
| C. | 步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁 | |
| D. | 海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程 |
11.海洋是一座巨大的化学资源宝库,如图是从海水中提取若干种化学物质的流程图,则下列说法正确的是( )
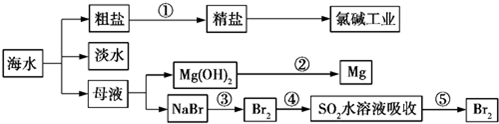

| A. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
10.化学是人类利用自然资源、丰富物质世界的重要科学依据.下列说法不正确的是( )
| A. | 我国许多城市已经推广使用清洁燃料以减少环境污染,如压缩天然气(CNG)、液化石油气(LPG),这两类燃料的主要成分均是烃类 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 当今,实现煤的综合利用的主要途径是通过煤的干馏、煤气化和煤液化而获得洁净的燃料和多种化工原料 | |
| D. | 工业上利用金属活泼性不同,采用不同的冶炼方法冶炼金属,如电解法冶炼铝、热还原法冶炼铁、热分解法冶炼铜 |
9.某卤代烃中化学键如图所示,则下列说法正确的是( )

0 167748 167756 167762 167766 167772 167774 167778 167784 167786 167792 167798 167802 167804 167808 167814 167816 167822 167826 167828 167832 167834 167838 167840 167842 167843 167844 167846 167847 167848 167850 167852 167856 167858 167862 167864 167868 167874 167876 167882 167886 167888 167892 167898 167904 167906 167912 167916 167918 167924 167928 167934 167942 203614

| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
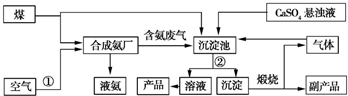
 2NH3.
2NH3. CaCO3↓+(NH4)2SO4.
CaCO3↓+(NH4)2SO4.